
分析 (1)由反应可知,A为二氧化硫,为氧化物,具有还原性;
(2)物质中均含氧元素,Cu与浓硫酸、CuO与硫酸、氢氧化铜与硫酸、氯化钡与硫酸均可生成硫酸铜;
(3)由反应可知,生成1molCuSO4转移2mol电子,该反应过程中转移了 0.2mol电子,生成0.1molCuSO4和0.1molSO2;
(4)反应后所得到的溶液,含硫酸铜和硫酸,与足量Ba(OH)2溶液充分反应生成硫酸钡沉淀.
解答 解:(1)由反应可知,A为二氧化硫,为氧化物,能与碱反应生成盐和水,为酸性氧化物,且具有还原性,使酸性KMnO4溶液褪色,SO2失去电子,
故答案为:d;SO2;
(2)CuSO4溶液、CuSO4•5H2O、Cu(OH)2、液态O2物质中均含氧元素,Cu与浓硫酸、CuO与硫酸、氢氧化铜与硫酸、碳酸铜与硫酸均可生成硫酸铜,
故答案为:均含有氧元素;abcd;
(3)由反应可知,生成1molCuSO4转移2mol电子,该反应过程中转移了 0.2mol电子,生成0.1molCuSO4,其质量为0.1mol×160g/mol=16g,0.1molSO2的体积为
1mol×22.4L/mol=2.24L,故答案为:16;2.24;
(4)反应后所得到的溶液,含硫酸铜和硫酸,与足量Ba(OH)2溶液充分反应生成硫酸钡沉淀,离子反应为Ba2++SO42-+2OH-+2H+=2H2O+BaSO4↓、Ba2++SO42-+2OH-+Cu2+=Cu(OH)2↓+BaSO4↓,故答案为:Ba2++SO42-+2OH-+2H+=2H2O+BaSO4↓;Ba2++SO42-+2OH-+Cu2+=Cu(OH)2↓+BaSO4↓.
点评 本题考查浓硫酸和铜反应及有关计算,注意稀硫酸与铜不反应,而题目中浓硫酸与铜反应开始后,由于自身被消耗且生成水,很快就变成稀硫酸,不再与铜反应.所以(3)中1.8mol的硫酸没被全消耗掉,不能用于计算,根据电子转移算出相应量,(4)中反应后的溶液溶质有硫酸和硫酸铜,离子守恒是解答的关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 蒸发结晶时应将溶液蒸干 | |
| D. | 稀释浓硫酸时,应将浓硫酸沿器壁缓缓注入水中,并用玻璃棒不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备1一溴丁烷的反应和实验装置如图:
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备1一溴丁烷的反应和实验装置如图:| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | |
| 正丁醇 | -89.53 | 117.25 | 0.81 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.28 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
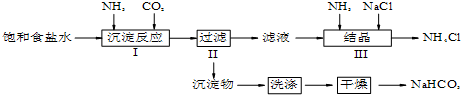
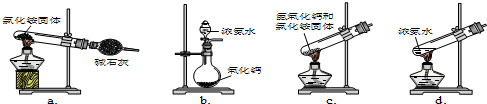
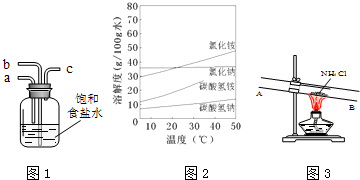
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
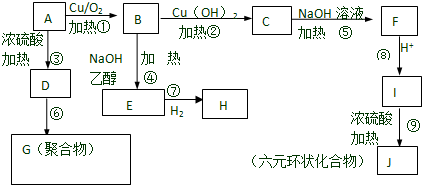
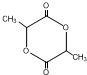 ;
;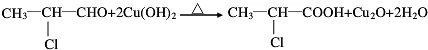 C→F
C→F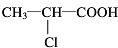 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$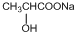 +NaCl+H2O
+NaCl+H2O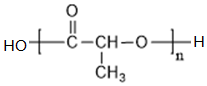 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 平行试验次数 | 1 | 2 | 3 |
| 0.25g样品消耗硫酸铈标准溶液的体积(ml) | 24.35 | 24.05 | 23.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验混合溶液 | A | B | C | D | E | F |
| 4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com