
下列各组中的离子 ,能在溶液中大量共存的是
,能在溶液中大量共存的是
A.K+ 、H+ 、SO42- 、OH- B.Na+ 、Ca2+ 、CO32- 、NO3-
C.Na+ 、H+ 、Cl- 、CO32- D.Na+ 、Cu2+ 、Cl- 、SO42-
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
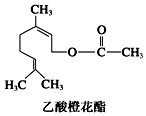
| A. | 分子式为C12H20O2 | |
| B. | 1 mol该有机物水解时只能消耗1 mol NaOH | |
| C. | 1mol该有机物可消耗3molH2 | |
| D. | 不能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16g甲烷所含原子数为4NA | |
| B. | 标准状况下,2.24LCH4和NH3混合气气体中含有的电子数目为NA | |
| C. | 标准状况下,11.2L的HCl溶于1.0L的水中,所得溶液中HCl的浓度为0.5mol/L | |
| D. | 常温下,5.6克铁与足量的盐酸反应,失去的电子数为0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
下列物质的水溶液能导电,但属于非电解质的是
A.Na2S B. Cl2 C. NaHCO3 D. CO2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学a卷(解析版) 题型:填空题
现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg/mol。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为__________mol
(2)该气体所含原子总数为______________。
(3)该气体在标准状况下的体积为________L
(4)该气体溶于1ml水中(不考虑反应),设溶液的密度为ρg/cm3,则该溶液的物质的量浓度为_______mol· L-1。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为__________mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学a卷(解析版) 题型:选择题
若m g氧气含n个氧气分子,则阿伏伽德罗常数为
A.2n B.16n/m C.n D.32n/m
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
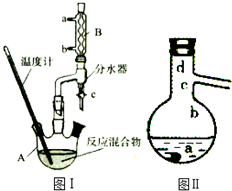 乙酸正丁酯是医药合成的重要中间体,某同学在实验室中用乙酸和正丁醇来制取,实验操作如下:
乙酸正丁酯是医药合成的重要中间体,某同学在实验室中用乙酸和正丁醇来制取,实验操作如下:| 化合物 | 相对分子质量 | 密度/(g•mL-1) | 沸点/℃ | 溶解度(g)/(100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 乙酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 1 1 6 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com