
【题目】化合物A的分子式为C3H6O2,它有如下图所示转化关系,已知D、E、F在加热条件下都能与碱性新制Cu(OH)2悬浊液生成砖红色沉淀:
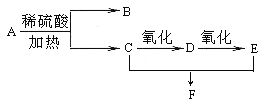
试回答下列问题:
(1)A的名称为 ,B所含官能团的名称为 ;
(2)写出A 生成B、C的化学反应方程式: ,
(3)写出C催化氧化为D的化学反应方程式: ;
(4)写出C和E生成F的化学反应方程式: ,反应类型是 。
【答案】
(1)乙酸甲酯,羧基;
(2)CH3COOCH3+H2O![]() CH3COOH+CH3OH;
CH3COOH+CH3OH;
(3)2CH3OH+O2![]() 2HCHO+2H2O;
2HCHO+2H2O;
(4)HCOOH+CH3OH![]() HCOOCH3+H2O;酯化反应或取代反应。
HCOOCH3+H2O;酯化反应或取代反应。
【解析】
试题分析:有机物C能连续被氧化,且C和E能发生反应生成F,则C为醇、D为醛、E为羧酸、F为酯,D、E、F都能发生银镜反应说明这三种物质中都含有醛基,则D的结构简式为HCHO、E的结构简式为HCOOH、F的结构简式为HCOOCH3、C的结构简式为CH3OH,A的分子式为C3H6O2,A发生水解反应生成B和C,C是甲醇,则B是乙酸,其结构简式为CH3COOH,A是乙酸甲酯,其结构简式为CH3COOCH3。
(1)通过以上分析知,A是乙酸甲酯,B是CH3COOH,B所含官能团的名称为羧基,故答案为:乙酸甲酯;羧基;
(2)A发生水解反应生成B和C,分液的化学反应方程式为CH3COOCH3+H2O![]() CH3COOH+CH3OH,故答案为:CH3COOCH3+H2O
CH3COOH+CH3OH,故答案为:CH3COOCH3+H2O![]() CH3COOH+CH3OH;
CH3COOH+CH3OH;
(3)C为CH3OH,C催化氧化为D的化学反应方程式为2CH3OH+O2![]() 2HCHO+2H2O,故答案为:2CH3OH+O2
2HCHO+2H2O,故答案为:2CH3OH+O2![]() 2HCHO+2H2O;
2HCHO+2H2O;
(4)在浓硫酸作催化剂、加热条件下,甲酸和甲醇发生酯化反应生成甲酸甲酯,反应方程式为:HCOOH+CH3OH![]() HCOOCH3+H2O,故答案为:HCOOH+CH3OH
HCOOCH3+H2O,故答案为:HCOOH+CH3OH![]() HCOOCH3+H2O;酯化反应。
HCOOCH3+H2O;酯化反应。


科目:高中化学 来源: 题型:
【题目】有A、B两种烃,含氢的质量分数相同,下列关于A和B的叙述中错误的是 ( )
A.A和B可能是同分异构体
B.A和B不一定是同系物
C.A和B完全燃烧后生成的水的质量相等
D.A和B含碳的质量分数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PM2.5是指大气中直径或小于或等于2.5微米的颗粒物,也叫可入肺颗粒物,与肺癌、哮喘等疾病的发生密切相关,是灰霾天气的主要原因,它来自它主要来自化石燃料的燃烧(如机动车尾气、燃煤)等列与PM2.5相关的说法不正确的是( )
A. 大力发展电动车,减少燃油汽车的尾气排放量
B. 开发利用各种新能源,减少对化石燃料的依赖
C. 多环芳烃是强致癌物,能吸附在PM2.5的表面进入人体
D. PM2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸二甲酯(简称DMC)是一种绿色化学品,可取代光气等有毒物质作为羰基化或甲基化试剂,如:
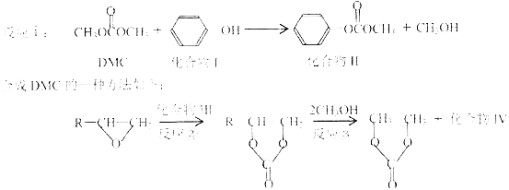
(1)化合物II核磁共振氢谱有 组峰;1mol该物质最多可以跟 mol氢气发生加成反应。
(2)反应①中副产物甲醇发生催化氧化反应的方程式为 。
(3)反应②原子利用率100%,则化合物Ⅲ的名称是 。化合物Ⅳ的结构简式是 ,反应③的反应类型是 。
(4)化合物V是化合物Ⅱ的一种同分异构体,其苯环上的一氯代物有两种,且能发生水解反应和银镜反应,则化合物V的结构简式为(写其中一种) 。
(5)一定条件下,![]() 与DMC 以物质的量之比为1∶1发生类似反应①的反应,请写出该反应的化学方程式 。
与DMC 以物质的量之比为1∶1发生类似反应①的反应,请写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家利用“组合转化”等技术对CO2进行综合利用。如用H2 和CO2在一定条件下可以合成乙烯:6H2(g)+2CO2(g)![]() C2H4 (g)+4H2O(g) △H= a kJ/mol
C2H4 (g)+4H2O(g) △H= a kJ/mol
(1)已知:①H2和C2H4的燃烧热分别为285.8kJ/mol和1411kJ/mol
②H2O(g)= H2O(l) △H= - 44 kJ/mol
则a= kJ/mol。
(2)不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法错误的是 ____________(填序号)。
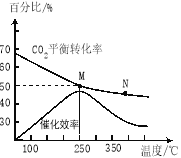
①M点的速率最大
②温度低于250℃时,随温度升高乙烯的产率增大
③M点时平衡常数比N点时平衡常数大
④为提高 CO2的转化率应在尽可能低的温度下进行反应
(3)若在密闭容器中充入体积比为 3∶1的H2和CO2,则图中M点时,产物C2H4的体积分数为 ;若要进一步提高乙烯的体积分数,可采取的措施有 。
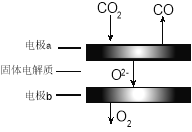
(4)利用高温电解技术可将CO2转化为高热值的燃料CO气体。
① 电极a发生的反应类型是 (填“氧化”或“还原”)反应。
② 高温电解的总反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231 ℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33 ℃、沸点为114 ℃。请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为________。
(2)用于微电子器件生产的锡粉纯度测定:
①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.1 000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是__________________;此锡粉样品中锡的质量分数:____________。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
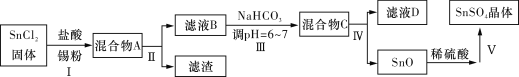
①步骤Ⅰ加入Sn粉的作用:____________________及调节溶液pH。
②步骤Ⅱ用到的玻璃仪器有烧杯、________________________。
③步骤Ⅲ生成SnO的离子方程式:__________________________。
④步骤Ⅳ中检验SnO是否洗涤干净的操作是___________________,证明已洗净。
⑤步骤Ⅴ操作依次为___________________、过滤、洗涤、低温干燥。
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为:_____________。实验室欲用下图装置制备少量SnCl4(夹持装置略),该装置存在明显缺陷,改进方法是_______________
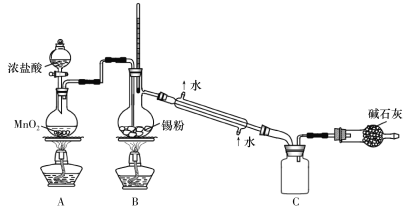
(5)利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液中通入标准状况下112mlCl2,恰好将Fe2+完全氧化。x值为
A.0.80 B.0.85 C.0.90 D.0.93
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。

(1)上述元素中单质的熔点最高的可能是________(填名称)。
(2)比较D、G氢化物的稳定性 (用化学式表示)。
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为: ;
(4)D、E、G、H四种元素最高价含氧酸的酸性由强到弱的顺序是: (填化学式)。
(5)A、D两种元素构成的两种烃X和Y,X是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平;Y是一种比水轻的油状液体,两种元素的质量比为12∶1,Y的相对分子质量为78。
①X的结构简式 。
②Y与浓硫酸与浓硝酸在50~60℃反应的化学反应方程式: ,反应类型________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com