
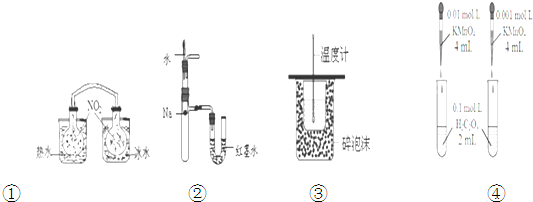
| A、装置①依据两容器内气体颜色变化,不能判断反应2NO2(g)?N2O4(g)平衡移动的方向 |
| B、装置②依据U管两边液面的高低判断Na和水反应的热效应 |
| C、装置③测定中和热 |
| D、装置④依据褪色快慢比较浓度对反应速率的影响 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
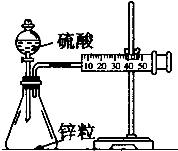 I.某校化学学习小组为了探究草酸(H2C2O4)的化学性质,设计了如下实验:
I.某校化学学习小组为了探究草酸(H2C2O4)的化学性质,设计了如下实验:| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸 溶液 | MnSO4固体 | 0.10mol/L KMnO4溶液 | 褪色 时间 |
| 1 | 750C | 一 | 一 | 1mL | 100s |
| 2 | 750C | 10滴 | 一 | 1mL | 40s |
| 3 | 750C | 10滴 | 加入少许 | 1mL | 3s |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 |
| 氢气体积(mL) | 50 | 120 | 224 | 392 | 472 | 502 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.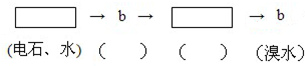
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验目的 | |||
| 实验 |  |  |  |
| 实验结论 | 结论: | ||
| 反应方程式 | |||
| 实验目的 | 探究卤素单质氧化性的相对强弱 | |
| 实验步骤 | 预期现象 | 离子方程式 |
| 1.将少量氯水分别加入盛有KBr和NaI溶液的试管中,振荡后加入CCl4,振荡、静置 | (1)溶液分层,上层几乎无色,下层为橙色. (2) | (1) (2) |
| 2.将少量溴水加入盛有NaI溶液的试管中,振荡后加入少量CCl4,振荡、静置 | (3) | |
| 实验结论并从原子结构上 解释原因 | 结论: 原因: | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.04 g |
| B、8.26 g |
| C、8.51 g |
| D、9.02 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com