
 ,故答案为:
,故答案为: ;
;| 67.2L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、硫酸铜、胆矾、CuSO4、酸 |
| B、碳酸钠、纯碱、NaCO3、盐 |
| C、银、水银、Hg、单质 |
| D、氢氧化钠、苛性钠、NaOH、碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
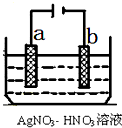 按要求完成下列问题:
按要求完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有1个 I-I键断裂,同时有1个H-H键形成 |
| B、有1个 I-I键断裂,同时有1个H-H键断裂 |
| C、有1个 I-I键断裂,同时有1个H-I键断裂 |
| D、有1个 I-I键断裂,同时有2个H-I键形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用焓变和熵变的数据可以确定一定温度、压强下化学反应过程是否一定会发生 |
| B、利用化学平衡常数的大小可判断化学反应可能进行的程度 |
| C、利用焓变的数据可以判断一个反应是吸热反应还是放热反应 |
| D、利用沸点的数据推测能否用蒸馏的方法将两种液体混合物进行分离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com