
| A、Ksp与温度有关 |
| B、由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 |
| C、向AgCl沉淀的溶解平衡中加入NaCl固体,AgCl平衡不移动 |
| D、若在Ca(OH)2溶液与FeCl2溶液中加足量稀硝酸,无沉淀产生 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
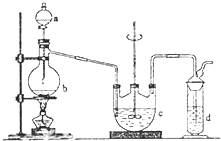 在实验室中可通过如下反应制取硫代硫酸钠Na2S2O3:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2
在实验室中可通过如下反应制取硫代硫酸钠Na2S2O3:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2查看答案和解析>>
科目:高中化学 来源: 题型:

| A、用KMnO4粉末制取O2 |
| B、用浓氨水和CaO制取NH3 |
| C、用Zn和稀硫酸制取H2 |
| D、用石灰石和稀盐酸制取CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与葡萄糖互为同分异构体 |
| B、可以与银氨溶液作用形成银镜 |
| C、与葡萄糖互为同系物 |
| D、可以使石蕊试液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 靛蓝是一种食品用合成色素,但对人体有害.使用时必须严格控制使用量.靛蓝允许小于0.1g?kg-1.靛蓝结构简式如图所示.下列关于靛蓝的叙述错误的是( )
靛蓝是一种食品用合成色素,但对人体有害.使用时必须严格控制使用量.靛蓝允许小于0.1g?kg-1.靛蓝结构简式如图所示.下列关于靛蓝的叙述错误的是( )| A、靛蓝可与溴水发生加成反应,使溴水褪色 |
| B、它的分子式是C16H10N2O2 |
| C、该物质分子量较大是高分子化合物 |
| D、它与氢气发生加成反应,1mol靛蓝需氢气最大量是9mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在蒸馏水中滴加浓H2SO4,KW不变 |
| B、CaCO3难溶于稀硫酸,也难溶于醋酸 |
| C、25℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸>VNaOH |
| D、NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com