
����Ŀ��.�״���Ϊһ�ֽϺõĿ�������Դ�����й㷺��Ӧ��ǰ����
��֪�ڳ��³�ѹ�·�Ӧ���Ȼ�ѧ����ʽ��
��CO(g)+2H2(g) ![]() CH3OH(g) H1=-90kJ��mol-1
CH3OH(g) H1=-90kJ��mol-1
��CO(g)+H2O(g) ![]() CO2(g) + H2(g) H2=-41kJ��mol-1
CO2(g) + H2(g) H2=-41kJ��mol-1
д���ɶ�����̼�������Ʊ��״����Ȼ�ѧ����ʽ��___________________��
��. ��֪�״��Ʊ����йػ�ѧ��Ӧ�Լ��ڲ�ͬ�¶��µĻ�ѧ��Ӧƽ�ⳣ�����±���ʾ��
��ѧ��Ӧ | ƽ�� ���� | �¶� | ||
500�� | 700�� | 800�� | ||
2H2(g) + CO(g) | K1 | 2.5 | 0.34 | 0.15 |
H2(g) + CO2(g) | K2 | 1 | 1.7 | 2.52 |
3H2(g)+CO2(g) | K3 | |||
��ش��������⣺
(1)��Ӧ����__________������ȡ����ȡ�����Ӧ
(2)�۲�٢ڢۿ��Ƶ���K1��K2��K3֮��Ĺ�ϵ����K3=_______����K1��K2��ʾ��
(3)ij�¶�ʱ����Ӧ��ʽ�и����ʵ�ƽ��Ũ�ȷ�����ʽ��20��c(CH2OH)=3��c(CO)��c3(H2)�����жϴ�ʱ���¶�Ϊ____________��
(4)500��ʱ��÷�Ӧ����ijʱ��H2(g)��CO2(g)��CH3OH(g)��H2O(g)��Ũ�ȷֱ�Ϊ0.4 mol�� L-1��1 mol��L-1��0.5 mol��L-1��0.4 mol��L-1molL-1�����ʱV������______V���棩���>���� ��=����<������
(5)��Ӧ��Ӧ�ۣ�һ�������½�H2(g)��CO2(g)�������3:1���ں��º��ݵ��ܱ�����������Ӧ��������˵���÷�Ӧ��ƽ��״̬����_____________��
A.��ϵ�ܶȱ��ֲ���
B.H2��CO2������ȱ��ֲ���
C.��������ƽ����Է���������ʱ����Ӧһ���ﵽƽ��״̬
D.���ƻ�CO2��2��̼��˫����ͬʱ�ƻ�H2O�е�2�����������Ӧһ���ﵽƽ��״̬
���𰸡� CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) H=-49kJ��mol-1�� ���� K1��K2 800�� < CD
CH3OH(g)+H2O(g) H=-49kJ��mol-1�� ���� K1��K2 800�� < CD
��������I.���⿼���Ȼ�ѧ��Ӧ����ʽ�ļ��㣬Ŀ�귴Ӧ����ʽΪCO2��3H2=CH3OH��H2O���٣��ڵó�CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ��H=(��90��41)kJ��mol��1=��49kJ��mol��1��II.���⿼��Ӱ�컯ѧƽ���ƶ������غͻ�ѧƽ�ⳣ���ļ��㣬��ѧƽ��״̬���жϣ���1����ѧƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬���ݱ������ݣ������¶ȵ����ߣ���ѧƽ�ⳣ�����٣�˵�������¶ȣ�ƽ�����淴Ӧ�����ƶ���������Ӧ�����Ƿ��ȷ�Ӧ����2�����ݻ�ѧƽ�ⳣ���ı���ʽ��K1=c(CH3OH)/[c2(H2)��c(CO)]��K2=[c(H2O)��c(CO)]/[c(H2)��c(CO2)]��K3=[c(CH3OH)��c(H2O)]/[c3(H2)��c(CO2)]�������K3=K1��K2����3��ʽ�ӱ��εõ���c(CH3OH)/[c2(H2)��c(CO)]=3/20=0.15�����¶�Ϊ800�棻��4����ʱ��Qc=0.4��0.5/(0.43��1)=3.125����ʱ��ƽ�ⳣ��ΪK3=K2��K1=2.5<3.125��˵����Ӧ���淴Ӧ������У���v(��)<v(��)����5��A����ֶ������壬�������������䣬����Ϊ����״̬��������䣬����ܶ��κ�ʱ�̶���ͬ�����ܶȲ��䣬����˵����Ӧ�ﵽƽ�⣬��A����B��Ͷ������������ϵ����Ͷ�룬����κ�ʱ�����ߵ�����ȶ���ȣ�������Ϊ�ﵽƽ��ı�־����B����C�������������䣬������Ӧ������У��������ʵ������٣�����M=m/n����˵�M���ٸı�˵����Ӧ�ﵽƽ�⣬��C��ȷ��D���ƻ�CO2��2��̼��˫����˵����Ӧ������Ӧ������У��ƻ�H2O��2����������˵����Ӧ���淴Ӧ������У������߱�ֵ����ϵ��֮�ȣ����˵����Ӧ�ﵽƽ�⣬��D��ȷ��
CH3OH(g)+H2O(g) ��H=(��90��41)kJ��mol��1=��49kJ��mol��1��II.���⿼��Ӱ�컯ѧƽ���ƶ������غͻ�ѧƽ�ⳣ���ļ��㣬��ѧƽ��״̬���жϣ���1����ѧƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬���ݱ������ݣ������¶ȵ����ߣ���ѧƽ�ⳣ�����٣�˵�������¶ȣ�ƽ�����淴Ӧ�����ƶ���������Ӧ�����Ƿ��ȷ�Ӧ����2�����ݻ�ѧƽ�ⳣ���ı���ʽ��K1=c(CH3OH)/[c2(H2)��c(CO)]��K2=[c(H2O)��c(CO)]/[c(H2)��c(CO2)]��K3=[c(CH3OH)��c(H2O)]/[c3(H2)��c(CO2)]�������K3=K1��K2����3��ʽ�ӱ��εõ���c(CH3OH)/[c2(H2)��c(CO)]=3/20=0.15�����¶�Ϊ800�棻��4����ʱ��Qc=0.4��0.5/(0.43��1)=3.125����ʱ��ƽ�ⳣ��ΪK3=K2��K1=2.5<3.125��˵����Ӧ���淴Ӧ������У���v(��)<v(��)����5��A����ֶ������壬�������������䣬����Ϊ����״̬��������䣬����ܶ��κ�ʱ�̶���ͬ�����ܶȲ��䣬����˵����Ӧ�ﵽƽ�⣬��A����B��Ͷ������������ϵ����Ͷ�룬����κ�ʱ�����ߵ�����ȶ���ȣ�������Ϊ�ﵽƽ��ı�־����B����C�������������䣬������Ӧ������У��������ʵ������٣�����M=m/n����˵�M���ٸı�˵����Ӧ�ﵽƽ�⣬��C��ȷ��D���ƻ�CO2��2��̼��˫����˵����Ӧ������Ӧ������У��ƻ�H2O��2����������˵����Ӧ���淴Ӧ������У������߱�ֵ����ϵ��֮�ȣ����˵����Ӧ�ﵽƽ�⣬��D��ȷ��


 ��ĩ��ϰ���ϵ�д�
��ĩ��ϰ���ϵ�д� ����ѧ�䵥Ԫ������ĩר����100��ϵ�д�
����ѧ�䵥Ԫ������ĩר����100��ϵ�д� �Ƹ�360�ȶ����ܾ�ϵ�д�
�Ƹ�360�ȶ����ܾ�ϵ�д� ���⿼����Ԫ���Ծ�ϵ�д�
���⿼����Ԫ���Ծ�ϵ�д� ��У���˳�̾�ϵ�д�
��У���˳�̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У����ڿ��淴ӦA+3B![]() 2C��������ƽ��ʱC������������¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ��ʾ�������ж���ȷ���ǣ� ��
2C��������ƽ��ʱC������������¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ��ʾ�������ж���ȷ���ǣ� ��
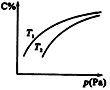
A. ������Ӧ����H��0����T 1 ��T 2
B. ѹǿ����ʱ����������ƽ����Է���������С
C. Bһ��Ϊ����
D. Aһ��Ϊ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ�����ӵ�������ֵ�������й�������ȷ����
A. ��2L0.2mol/L��Na2CO3��Һ�У�����������С��0.4NA
B. �ڱ�״���£�3.36LS03���еĵ�����Ϊ6NA
C. ��0.5molNH4N03����ϡ��ˮ��ʹ��Һ�����ԣ���Һ��NH4+��ĿΪ0.5NA
D. �ܱ�������lmolNO��0.5molO2��ַ�Ӧ������ķ�����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���Ա�������������Ϊ������̬�Ĺ���̼�������µ�̼�ṹ��������������ĭ����������ĭ̼����ʯ�Ĺ�ϵ�ǣ� ��
A. ͬ�������� B. ͬλ�� C. ͬϵ�� D. ͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ������60%��þ�ǴӺ�ˮ����ȡ�ģ���Ҫ�������£�
����˵������ȷ���ǣ� ��
A. Ϊʹ��ˮ�е�MgSO4ת����Mg��OH��2���Լ��ٿ�ѡ��ʯ����
B. �����Լ��ٺ���õ�Mg��OH��2�����ķ����ǹ���
C. �����Լ��ڷ�Ӧ�����ӷ���ʽΪ��OH��+H+=H2O
D. ͨ��������ڵ���ˮMgCl2�õ�48gMg����ת��4mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�������������·�Ӧ��ȡ����������NaNO2��NH4Cl===NaCl��N2����2H2O�����ڸ÷�Ӧ������˵����ȷ���ǣ� ��
A��ÿ����1 mol N2ת�Ƶĵ��ӵ����ʵ���Ϊ6 mol
B��N2���������������ǻ�ԭ��
C��NH4Cl�еĵ�Ԫ�ر���ԭ
D��NaNO2��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵı��淽���У�������ǣ�
A. �����Ҫ����������ƿ��
B. ���Ƶ���ˮҪ��������ɫϸ��ƿ�У���������������
C. ����Һ��Ҫ�����ڴ�����������ɫϸ��ƿ�У�����Һ�������ˮ��
D. ���ʵ�Ҫ��������ɫ���ƿ�У���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£�0.200 molL-1��HA��Һ��0.200 molL-1��NaOH��Һ�������Ϻ�������Һ�в�������ּ�Ũ�����±�������˵����ȷ����
�� | X | Y | Na+ | A- |
Ũ��/��mol��L-1�� | 8.00 | 2.50 | 0.100 | 9.92 |
A. 0.1mol��L-1HA��Һ��pH=1 B. ���¶���Kw=1.0![]() 10-14
10-14
C. ��X��ʾOH-��Y��ʾH+ D. �����Һ�У�n��A-��+n��X��=n��Na+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ�����ӵ�����������˵����ȷ���ǣ� ��
A. 7.8 g Na2O2�к��е���������ĿΪ0.2NA
B. ��״���£�2.24 L CHCl3�ķ�����Ϊ0.1NA
C. 1 L 0.1 mol/L Al2��SO4��3��Һ�У�Al3+����ĿΪ0.2NA
D. 0.1 mol Fe������ϡHNO3��Ӧ��ת�Ƶ�����Ϊ0.3NA
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com