
| A. | CN-可以和稀硫酸反应生成HCN | B. | CN-可被Cl2氧化成(CN)28 | ||
| C. | 在水溶液中(CN)2可被F-还原 | D. | HCN的电子式为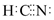 |
分析 A、HCN为弱酸,利用强酸制取弱酸的原理来分析;
B、CN-的还原性介于I-与Br-之间,利用氧化还原反应来分析;
C、利用氧化性的强弱来分析氧化还原反应;
D、利用最外层电子数来分析电子式.
解答 解:A、HCN为弱酸,根据强酸制弱酸规律可知,CN-可以和稀硫酸反应生成HCN,故A正确;
B、由于CN-的还原性介于I-与Br-之间,则Cl2可氧化CN-而生成(CN)2,故B正确;
C、因F-的还原性弱于CN-,故(CN)2与F-不反应,故C错误;
D、H最外层1个电子,C最外层4个电子,N最外层5个电子,则HCN的电子式为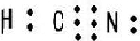 ,故D正确;
,故D正确;
故选C.
点评 本题考查学生利用信息中离子的性质的相似性及氧化还原反应来分析解答问题,明确信息的应用,并熟悉强酸制取弱酸、氧化性、还原性的强弱、原子的最外层电子数等知识来解答,题目难度中等.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:选择题
| A. | 升高温度时,正反应速率加快,逆反应速率减慢,平衡逆向移动 | |
| B. | 若x=1,新平衡下E转化率为50% | |
| C. | 若x=2,新平衡下F的平衡浓度为0.5a mol/L | |
| D. | 若x=2,换成恒压容器,则达到平衡所需时间比恒容容器所需时间短 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,20mlNH3与60mlO2所含分子个数比为1:3 | |
| B. | 在化学反应中,1mol金属镁变为镁离子时失去电子数为NA | |
| C. | 在标准状况下,1mol水的体积为22.4L | |
| D. | 2molCaCl2中Cl-的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5s时,正、逆反应速率都达到最大 | |
| B. | 前5s内平均反应速率υ(Y)=0.1 mol/( L•s) | |
| C. | 达平衡时,各物质的浓度都保持不变,反应停止 | |
| D. | 升高温度,测得容器中密度不变时,表示该反应已经达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的摩尔质量等于其相对原子质量或相对分子质量 | |
| B. | 摩尔是7个基本物理量之一 | |
| C. | 46 g NO2和N2O4的混合物中含有的氮原子数为NA | |
| D. | 1molCO2所占的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中,氧化剂与还原剂的物质的量之比为2:5 | |
| B. | 反应②中,Cu3P既是氧化产物又是还原产物 | |
| C. | 反应②中,当有5mol CuSO4发生反应时,共转移电子10mol | |
| D. | 反应①中CuSO4做氧化剂,反应②中CuSO4作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失 | |
| B. | 在加入铝粉能放出氢气的溶液中:K+、NH4+、NO3-、Cl-一定能够大量共存 | |
| C. | 利用食醋除去热水瓶水垢中CaCO3的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 除去乙酸乙酯中的少量乙酸:加入过量的NaOH溶液,静置分层后,除去水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向含有1mol AlCl3的溶液中加入足量NaOH溶液就会产生78g 白色沉淀 | |
| B. | 1 mol O2与金属Na充分反应,转移电子的数目为4 NA | |
| C. | 向0.1mol的碳酸钾固体中缓缓滴加0.2mol的稀盐酸会产生2.24L的CO2气体 | |
| D. | 标准状况下,用一充满干燥HCl气体的烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内盐酸的物质的量的浓度为$\frac{1}{22.4}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com