
分析 (1)FeS2+C+O2→Fe3O4+CO+S中,Fe、C、S元素的化合价升高,O元素的化合价降低,结合电子、原子守恒分析;
(2)①浓盐酸易挥发;
②用稀盐酸和锌粒反应制取氢气,H元素的化合价由+1价降低为0,且生成盐;
③用盐酸除去铁表面的铁锈,反应生成氯化铁和水,氯化铁为盐.
解答 解:(1)FeS2+C+O2→Fe3O4+CO+S中,Fe、C、S元素的化合价升高,O元素的化合价降低,FeS2、C均为还原剂被氧化,结合电子、原子守恒可知反应为3FeS2+2C+3O2═Fe3O4+2CO+6S,由 反应可知,生成6molS时,5mol还原剂被氧化,则生成3mol硫,被氧化的物质的物质的量为2.5 mol,
故答案为:3FeS2+2C+3O2═Fe3O4+2CO+6S;2.5mol;
(2)①浓盐酸易挥发,则浓盐酸长时间露置在空气中,溶液的质量减轻,故答案为:d;
②用稀盐酸和锌粒反应制取氢气,H元素的化合价由+1价降低为0,且生成盐,则盐酸表现氧化性和酸性,离子反应为Zn+2H+═Zn2++H2↑,
故答案为:ab;Zn+2H+═Zn2++H2↑;
③用盐酸除去铁表面的铁锈,反应生成氯化铁和水,氯化铁为盐,则盐酸表现酸性,离子反应为,故答案为:a;Fe2O3+6H+═2Fe3++3H2O.
点评 本题考查物质的性质及氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NaCl的电子式为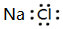 | |
| B. | NaClO只含有离子键 | |
| C. | 当释放2.24L Cl2时,一定有6.02×1022个氯分子扩散到室内 | |
| D. | 使用消毒液时滴加食醋可加快作用发挥,其原因用离子方程式表示为:ClO-+CH3COOH=HClO+CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
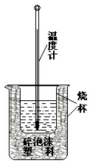 50ml 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组用如图所示装置电解CuSO4溶液,测定铜的相对原子质量.
某化学兴趣小组用如图所示装置电解CuSO4溶液,测定铜的相对原子质量.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2•t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.7 | 6.7 |
| 2 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
| 3 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 元素C、D、E的最高价氧化物对应的水化物之间两两都可以发生反应 | |
| B. | 1mol由元素A、B组成且含有18 mol e-的化合物只有一种 | |
| C. | 含D元素的盐溶液只能显酸性,不可能显碱性 | |
| D. | 化合物AE与CE含有相同类型的化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a=b时,发生的离子总反应为:2OH-+CO2+Ba2+═BaCO3↓+H2O | |
| B. | 当3a=2b时,发生的离子总反应为:6OH-+3CO2+2Ba2+═2BaCO3↓+3H2O+CO32- | |
| C. | 当$\frac{3}{2}$a<b<3a时,溶液中含有n(CO32-):n(HCO3-)=(3a-b):(2b-3a) | |
| D. | 当3a=b时,溶液中Na+、Ba2+与HCO3-的物质的量之比为1:1:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com