
 SO2和NOx在化学工业上有重要用途,也是大气污染的主要来源,开发和利用并重,预防和治理并举是当前工业上和环境保护领域研究的主要课题之一.
SO2和NOx在化学工业上有重要用途,也是大气污染的主要来源,开发和利用并重,预防和治理并举是当前工业上和环境保护领域研究的主要课题之一.分析 (1)①根据平衡常数只受温度的影响判断;
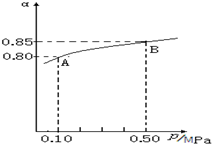
②由图象可知压强为0.10MPa时SO2的为80%,根据三段式计算各物质的平衡浓度,再计算反应速率和平衡常数;
(2)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
根据盖斯定律$\frac{①+②}{2}$可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),以此计算反应热,结合元素的化合价变化计算转移的电子数.
解答 解:(1)①平衡常数只受温度的影响,平衡状态由A变到B时,温度没改变,则k(A)=k(B);
故答案为:=;
②由图象知,体系总压强为0.10MPa时SO2的平衡转化率为0.8,根据三段式:
2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)
起始量:2.0mol 1.0mol 0
转化量:1.6mol 0.8mol 1.6mol
平衡量:0.4mol 0.2mol 1.6mol
则这一段时间内SO2的平均反应速率为$\frac{1.6mol÷10L}{40s}$=0.0040mol•L-1•s-1;该反应的平衡常数为K=$\frac{(1.6mol÷10L)^{2}}{(0.4mol÷10L)^{2}×(0.2mol÷10L)}$=800L•mol-1;
故答案为:0.0040mol•L-1•s-1;800L•mol-1;
(2)①已知:ⅠCH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
ⅡCH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
根据盖斯定律(Ⅰ+Ⅱ)÷2可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol,取标准状况下4.48LCH4完全反应,则n(CH4)=$\frac{4.48L}{22.4L/mol}$=0.2mol,
则整个过程中转移的电子总数为:0.20mol×8mol=1.60mol;
故答案为:1.6mol;
②若全部为NO,则发生CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1,放出的热量为0.2mol×1160kJ•mol-1=232kJ,
若全部为NO2,则发生CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ/mol,放出的热量为0.2mol×867kJ/mol=173.4kJ,
则放出的总热量Q的取值范围是173.4kJ<Q<232kJ;
故答案为:173.4kJ<Q<232kJ.
点评 本题考查化学平衡及化学反应及能量,侧重于学生的分析能力和计算能力的考查,为高频考点,题目难度中等,本题易错点为化学平衡常数的计算,注意计算过程的把握.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的溶解性为难溶,则该物质的溶解度为0 | |
| B. | 某离子被沉淀完全是指该离子在溶液中的浓度为0 | |
| C. | 通过沉淀反应能将大部分杂质离子沉淀 | |
| D. | 难溶电解质的溶度积越小,溶解度越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0×10-6mol/L | B. | 3.2×10-6mol/L | C. | 2.0×10-9mol/L | D. | 3.2×10-9mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑥⑦ | B. | ①③④⑤ | C. | ②④⑤ | D. | ①②⑤⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com