
| A、Fe2(SO4)3溶液中加入过量Fe粉 |
| B、A1(OH)3中加入过量NaOH溶液 |
| C、浓H2SO4中加入过量Cu片,加热 |
| D、Ca(C1O)2溶液中通入过量CO2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
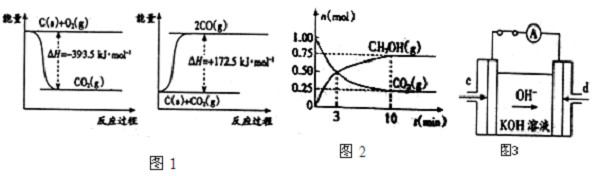
| 弱电解质 | H2CO3 | NH3?H2O |
| 电离平衡常数(25℃) | Ka1=4.3×10-7 Ka2=5.61×10-1 | Kb=1.77×10 |
| Kw |
| Kb |
| Kw |
| Ka2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2SO3溶液中通入CO2溶液变浑浊,继续通入CO2至过量,浑浊消失 |
| B、均不能采取将溶液直接蒸干的方法制得AlCl3、Al2( SO4)3、Fe Cl3、Fe2( SO4)3 |
| C、Na、Mg、Cl是海水中的重要元素,从海水中制备这三种元素单质的反应都定存在氧化还原反应 |
D、元素X的单质及元素X与Y形成的化合物能按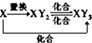 关系发生转化,则X可为Fe或S 关系发生转化,则X可为Fe或S |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O和Na2O2组成元素相同,化学性质也完全相同 |
| B、向硫酸铝溶液中逐滴加人过量氢氧化钡溶液,会出现先沉淀后完全溶解的现象 |
| C、等物质的量浓度的NH4Cl和CH3COONH4溶液中的c( NH4+)相等 |
| D、高纯度二氧化硅广泛用于制光导线维,光导纤维遇强碱时会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、应用高效洁净的能源转换技术,在大型燃煤锅炉上安装低氮燃烧器,并采用烟气脱硝技术 |
| B、加强道路扬尘控制强化路面保洁洒水防尘 |
| C、推广和使用脱硫技术,降低硫氧化物的排放 |
| D、研究采煤、采油新技术增加汽油、柴油等能源的供应量,提倡以汽车代步的现代消费与生活理念 |
查看答案和解析>>
科目:高中化学 来源: 题型:
134 55 |
137 55 |
| A、铯元素的相对原子质量约为133 | ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com