
分析 周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a的核外电子总数与其周期数相同,则a是H元素;c的最外层电子数为其内层电子数的3倍,原子最外层电子数是6,所以c是O元素;d与c同族,则d是S元素;b的价电子层中的未成对电子有3个,且原子序数小于c,则b是N元素;e的最外层只有一个电子,但次外层有18个电子,则e是Cu元素,据此进行答题.
解答 解:周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a的核外电子总数与其周期数相同,则a是H元素;c的最外层电子数为其内层电子数的3倍,原子最外层电子数是6,所以c是O元素;d与c同族,则d是S元素;b的价电子层中的未成对电子有3个,且原子序数小于c,则b是N元素;e的最外层只有一个电子,但次外层有18个电子,则e是Cu元素,
(1)e为铜元素,其基态核外电子总数为26,其基态原子电子排布式为:[Ar]3d104s1,
故答案为:[Ar]3d104s1;
(2)b、c、d分别是N、O、S元素中,元素的非金属性越强,其第一电离能越大,同一周期元素中,第一电离能随着原子序数的增大呈增大趋势,但第VA族元素大于相邻元素,所以N、O、S中第一电离能从大到小的顺序为:N>O>S,
故答案为:S<O<N;同一周期,随着原子序数的增加,元素的第一电离能呈现逐渐增大的趋势,但氮元素的最外层电子达到半充满的稳定构型,其第一电离能大于氧元素,同主族自上而下,元素第一电离能减小,氧元素第一电离能大于硫元素;
3)a是H元素,a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子为NH3,氨气分子中氮原子含有3个共价键和一个孤电子对,所以该分子的中心原子的杂化方式为sp3;分子中既含有极性共价键、又含有非极性共价键的化合物是H2O2、N2H4,
故答案为:sp3;H2O2、N2H4;
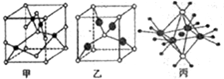
(4)O、Cu形成的化合物,晶胞甲中,白色球数目=1+8×$\frac{1}{8}$+2×$\frac{1}{2}$+4×$\frac{1}{4}$=4,黑色球数目为4,故该晶体中Cu、O原子数目之比为1:1,该化合物为CuO;晶胞乙中白色球数目=1+8×$\frac{1}{8}$=2,黑色球数目为4,为A2B型,故该化合物化学式为Cu2O;Cu2O中Cu的d轨道为全充满状态,较稳定,CuO高温易转化为Cu2O,
故答案为:CuO;Cu2O;Cu2O中Cu的d轨道为全充满状态,较稳定;
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,说明该阴离子价层电子对个数是4且不含孤电子对,应为SO42-;
阳离子呈轴向狭长的八面体结构(如图2所示),阳离子为Cu2+,配位数是6,在八面体上下顶点上分子含有两个共价键且含有两个孤电子对,为H2O分子,有2个,正方形平面上四个顶点上分子含有3个共价键且含有一个孤电子对,所以为NH3分子,有4个,其化学式为[Cu(NH3)4(H2O)2]SO4,H2O和Cu2+的配位键比NH3与Cu2+的弱,所以该化合物加热时首先失去的组分是H2O,故答案为:SO42-;H2O;H2O和Cu2+的配位键比NH3与Cu2+的弱.
点评 本题是对物质结构和性质的考查,涉及电离能、核外电子排布、分子结构、晶胞计算、配合物等知识点,对于分子空间结构,采取逆向形式进行考查,具有一定的开放性,增大题目难度.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 签別甲烷和乙烯 | 分别将两种气体通入酸性高锰酸钾溶液,观察溶液是否褪色 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN 溶液,双察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,溶液颜色变深 |
| D | 除去乙酸乙酯中的乙酸 | 用过量的饱和碳酸钠溶液洗涤后分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
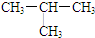 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 巴豆酸的官能团是:碳碳双键、羧基 | |
| B. | 纯碱溶液、溴水、乙醇、酸高锰酸钾溶液均可与巴豆酸反应 | |
| C. | 巴豆酸的化学式为C4H6O | |
| D. | 巴豆酸与丁酸互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 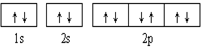 可表示单核10电子粒子基态时电子排布 可表示单核10电子粒子基态时电子排布 | |
| B. | 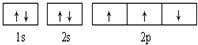 此图错误,违背了泡利原理 此图错误,违背了泡利原理 | |
| C. | 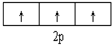 表示基态N原子的价电子排布 表示基态N原子的价电子排布 | |
| D. |  表示处于激发态的B的电子排布图 表示处于激发态的B的电子排布图 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯可发生加成反应 | |
| B. | 石油干馏可得到汽油、煤油等 | |
| C. | 淀粉、纤维素完全水解后的产物相同 | |
| D. | 油脂属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
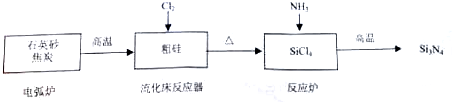
| 物质 | Si | SiCl4 | Cl2 |
| 沸点/℃ | 2355 | 57.6 | -34.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,金属单质一定是还原剂,非金属单质一定是氧化剂 | |
| B. | 某元素在化学反应中,由化合态变为游离态,则该元素一定被还原 | |
| C. | 在氧化还原反应中,氧化剂和还原剂可能是同一种物质 | |
| D. | 有单质生成的反应一定是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com