
【题目】某溶液X中仅可能含有K+、Na+、Fe2+、Fe3+、NH4+、SO42-、SO32-、CO32-、I-、Cl-中的一种或多种,且溶液中各离子浓度相同。现进行下列实验,下列说法正确的是 ( )

A.该溶液X中可能有Fe3+、Na+
B.该溶液可能由是硫酸亚铁、碘化钾和氯化铵溶于水后得到的
C.如果气体Y能使湿润的蓝色石蕊试纸变红,说明溶液中一定含有NH4+
D.取样溶液Z,滴加氯化钡溶液出现沉淀,可推出X中一定存在SO42-、SO32-中的某一种
【答案】B
【解析】
由实验流程可知,与过量氯水反应后的溶液中加入CCl4萃取后下层呈紫红色,说明原溶液中含有I-,则能够氧化I-的Fe3+不能同时存在于溶液中;此时上层的水溶液中一定含有氯水还原生成的Cl-,所以在该溶液中加入AgNO3生成的白色沉淀,不能说明原溶液中是否存在Cl-;另外一份加入NaOH,加热,产生红褐色沉淀说明溶液中存在Fe3+,说明原溶液中含有Fe2+,Fe2+的存在说明原溶液中不含有CO32-和SO32-;生成气体Y,说明原溶液中含有NH4+,Y为氨气;Z的焰色反应为黄色说明含钠离子,但不能确定原溶液中是否含钠离子,透过蓝色钴玻璃观察焰色反应为紫色火焰证明一定含钾离子,结合溶液中各离子浓度相同分析解答。
A.根据上述分析,该溶液X中一定没有Fe3+,故A错误;
B.根据上述分析,该溶液中一定存在K+、Fe2+、I-、NH4+,溶液中各离子浓度相同,根据溶液的电中性原则,溶液中还一定含有SO42-、Cl -,溶液可能是硫酸亚铁、碘化钾和氯化铵溶于水后得到的,故B正确;
C.氨气是碱性气体,不能使湿润的蓝色石蕊试纸变红,此现象不能说明溶液中一定含有NH4+,故C错误;
D.根据上述分析,原溶液中不存在SO32-,故D错误;
故选B。


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】把含(NH4)2SO4和NH4NO3的混合液aL分成两等份。一份加入bmolNaOH并加热,恰好把NH3全部赶出;另一份需消耗cmolBaCl2沉淀反应恰好完全,则原溶液中NO3-的浓度为()
A.![]() mol/LB.
mol/LB.![]() mol/LC.
mol/LC.![]() mol/LD.
mol/LD.![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组探究石蜡油分解产物,设计了如图实验方案。下列说法错误的是
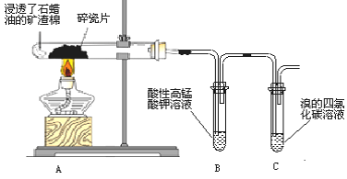
A.碎瓷片有催化和积蓄热量的作用
B.点燃C 出口处,火焰明亮,伴有黑烟
C.B、C 中溶液均褪色,反应类型相同
D.结束反应时,先撤出导管,再停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R 皆为前20号元素,其原子半径与化合价的关系如图所示。下列说法错误的是

A.QX 中只存在离子键
B.简单离子半径:r(M-)>r(Q+)>r(R2+)
C.X、Y、Z 三种元素组成的化合物可能是盐或碱
D.ZM3 各原子最外层电子数均满足8 电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是核电荷数依次增大的六种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置_________
(2)F元素的最高价氧化物对应的水化物的化学式为________。
(3)元素C、D、E形成的简单离子半径由小到大的顺序________(用离子符号表示)。
(4)写出化合物D2C2的电子式:________。
(5)E、F的简单离子的还原性大小顺序为:_________。
(6)已知E单质和F单质的水溶液反应会生成两种强酸,其离子方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中的一些常见物质有如图转化关系。其中A、H为空气中的主要成分,气体B能使湿润的红色石蕊试纸变蓝,气体D遇到A很快变成红棕色E,C属于氧化物,I是紫红色金属单质。X为常见液体(部分反应条件及生成物没有全部列出)。

回答下列问题。
(1)C的化学式为________。
(2)X的电子式为________。
(3)写出反应①的化学方程式__________________________________________。
(4)写出反应②的离子方程式__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(除H2O外,含有CCl4、I2、![]() 等)中回收碘,实验过程如下:
等)中回收碘,实验过程如下:

(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为_______;该操作将I2还原为I-的目的是___________________。
(2)操作![]() 的名称为__________。
的名称为__________。
(3)氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是__________________;仪器a的名称为________;仪器b中盛放的溶液为__________。

(4)已知:![]() ;某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3-中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO3-的实验方案(实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液)。
;某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3-中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO3-的实验方案(实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液)。
①取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;
②_______________________________________________________________________________;
③另从水层中取少量溶液,加入1-2mL淀粉溶液,加盐酸酸化后,滴加Na2SO3溶液,若溶液变蓝说明废水中含有IO3-;否则说明废水中不含有IO3-。
(5)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂和水处理剂。现用ClO2氧化酸性含废液回收碘。完成ClO2氧化I-的离子方程式:________________________________。
(6)“碘量法”是一种测定S2-含量的有效方法。立德粉ZnS·BaSO4是一种常用的白色颜料,制备过程中会加入可溶性的BaS,现用“碘量法”来测定立德粉样品中S2-的含量。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000 mol/L 的I2-KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5min,有单质硫析出。以淀粉为指示剂,过量的I2用0.1000 mol/L Na2S2O3 滴定,反应式为I2 + 2S2O32-=2I-+ S4O62-。测定消耗Na2S2O3溶液体积V mL。立德粉样品S2-含量为__________(写出表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含Fe(NO3)3、Cu(NO3)2、HNO3的某稀溶液,若向其中逐步加入铁粉,溶液中Fe2+浓度与加入铁粉的物质的量之间的关系如右图所示,则该溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )

A. 1∶1∶3B. 1∶2∶4C. 1∶1∶4D. 1∶3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,利用CO2合成CH3OH的反应如下: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1,研究发现,反应过程中会有副反应:CO2(g)+H2(g)
CH3OH(g)+H2O(g) △H1,研究发现,反应过程中会有副反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2。温度对CH3OH、CO的产率影响如图所示.下列说法中,不正确的是( )
CO(g)+H2O(g) △H2。温度对CH3OH、CO的产率影响如图所示.下列说法中,不正确的是( )

A. △H1<0,△H2>0
B. 增大压强有利于加快合成反应的速率
C. 生产过程中,温度越高越有利于提高CH3OH的产率
D. 合成CH3OH反应的平衡常数表达式是K=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com