
分析 W是宇宙中最丰富的元素,W为H元素;
X、Z元素原子基态时,核外电子均排布在3个能级上,则X、Z为第2周期元素,它们的价电子层上均有两个未成对电子,则X为C元素,Z为O元素;
X为C元素,Z为O元素,W、X、Y、Z、Q是原子序数依次增大的前四周期元素,则Y为N元素;
向含有Q2+的溶液中滴加氨水,形成蓝色沉淀,再滴加氨水,沉淀溶解,得到深蓝色溶液,则Q为Cu元素.由此解答.
(1)同周期,随原子序数增大第一电离能增大,但N原子的2p电子半满为稳定结构;同周期元素从左到右,元素的电负性逐渐增强;
(2)根据等电子体中原子数相同、价电子数相同分析;
(3)[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,向溶液中加入乙醇后会析出蓝色晶体[Cu(NH3)4]SO4;
(4)根据中心原子电子对数判断杂化方式;H、C形成有机化合物;
(5)根据晶胞边长a=$\root{3}{\frac{m}{ρ}}$计算晶体中最邻近的原子核间距,原子在晶胞中的空间利用率=$\frac{{V}_{球}}{{V}_{晶胞}}×100%$.
解答 解:W是宇宙中最丰富的元素,W为H元素;
X、Z元素原子基态时,核外电子均排布在3个能级上,则X、Z为第2周期元素,它们的价电子层上均有两个未成对电子,则X为C元素,Z为O元素;
X为C元素,Z为O元素,W、X、Y、Z、Q是原子序数依次增大的前四周期元素,则Y为N元素;
向含有Q2+的溶液中滴加氨水,形成蓝色沉淀,再滴加氨水,沉淀溶解,得到深蓝色溶液,则Q为Cu元素,
由此知W为H,X为C,Y为N,Z为O,Q为Cu,
(1)同周期,随原子序数增大第一电离能增大,但N原子的2p电子半满为稳定结构,则第一电离能N>O,同周期元素从左到右,元素的电负性逐渐增强,则电负性O>N,故答案为:大于;小于;
(2)CO含有2个原子14个电子,所以CO互为等电子体的分子或离子的化学式为:N2、CN-(或O22+、C22-、NO+),故答案为:CN-;
(3)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液,涉及的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,再向深蓝色透明溶液加入乙醇,由于乙醇极性比水小,[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,所以会析出深蓝色的晶体Cu(NH3)4SO4•H2O,形成4个配位键,配体为NH3,中心离子的电子排布式为[Ar]3d9,
故答案为:乙醇极性比水小,[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,故有晶体析出;[Ar]3d9;NH3;
(4)NH3分子中N原子电子对数为$\frac{5+1×3}{2}=4$,故杂化方式为sp3杂化,由YW3、Y2W4、Y3W5、Y4W6…分析判断这组化合物的通式为NnHn+2,C、H元素形成烃类有机化合物,数目庞大,故答案为:sp3杂化;NnHn+2;少;
(5)Cu单质的晶体属于面心立方最密堆积,一个晶胞中含有Cu原子数目为$8×\frac{1}{8}+6×\frac{1}{2}=4$,边长a=$\root{3}{\frac{m}{ρ}}$=$\root{3}{\frac{4M}{d{N}_{A}}}$,晶体中最邻近的原子核间距为$\frac{\sqrt{2}}{2}a$=$\frac{\sqrt{2}}{2}\root{3}{\frac{4M}{d{N}_{A}}}$,
原子在晶胞中的空间利用率=$\frac{{V}_{球}}{{V}_{晶胞}}×100%$=$\frac{4×\frac{4}{3}π{(\frac{\sqrt{2}}{4}a)}^{3}}{{a}^{3}}$=$\frac{\sqrt{2}π}{6}$.故答案为:$\frac{\sqrt{2}}{2}\root{3}{\frac{4M}{d{N}_{A}}}$;$\frac{\sqrt{2}π}{6}$.
点评 本题综合考查物质的结构和性质,侧重于学生的分析能力的考查,注意把握杂化类型以及价层电子数的判断,难度中等.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目减少 | |
| B. | 再加CH3COONa固体促进醋酸的电离 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积 (mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加过程中,当溶液中c(Cu 2+)=2.2×10-2mol/L时,溶液的pH=9 | |
| B. | 滴加过程中,当溶液的pH=7时,溶液中2c(NH4+)=c(SO4 2-) | |
| C. | 若滴加pH=11的Na0H溶液,Cu2+完全沉淀时消耗溶液的体积小于V | |
| D. | 若将氨水加水稀释,则稀释过程中,c(NH4+)/c(NH3•H2O)始终保持增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
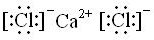 ,属于离子化合物.
,属于离子化合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com