
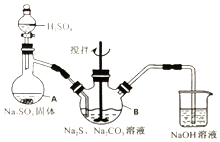
 硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”.它易溶于水,难溶于乙醇,加热、遇酸均易分解.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”.它易溶于水,难溶于乙醇,加热、遇酸均易分解.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:| 编号 | 1 | 2 | 3 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.98 | 22.50 | 20.02 |
分析 (1)根据仪器构造可知;
(2)Na2S2O3在酸性条件下会反应生成S和二氧化硫;
(3)二氧化硫与硫化钠、碳酸钠反应生成Na2S2O3和二氧化碳,结合质量守恒确定产物并配平;
(4)从上述生成物混合液中获得较高产率Na2S2O3?5H2O,在混合液中加入活性碳脱色,然后趁热过滤,防止溶液中Na2S2O3?5H2O析出,将除去碳后的滤液进行蒸发浓缩、冷却结晶、抽滤、洗涤、干燥,可得粗晶体,据此答题;
(5)淀粉溶液作指示剂,用度为0.500mol/LI2的标准溶液进行滴定溶液中的碘,滴定终点时溶液由无色变蓝色;根据2S2O32-~I2,根据标准的消耗计算样品中Na2S2O3•5H2O的质量,据此计算纯度;
(6)Na2S2O3常用作脱氧剂,在溶液中易被Cl2氧化成SO42-,硫元素化合价升高,则氯元素化合价降低,生成氯离子,据此书写.
解答 解:(1)仪器A为蒸馏烧瓶;
故答案为;蒸馏烧瓶;
(2)Na2S2O3在酸性条件下会生成S和二氧化硫,产率会下降,其反应的离子方程式为:S2O32-+2H+=S↓+H2O+SO2↑;
故答案为:S2O32-+2H+=S↓+SO2↑+H2O;
(3)二氧化硫与硫化钠、碳酸钠反应生成Na2S2O3和二氧化碳,反应为4SO2+2Na2S+Na2CO3=CO2+3Na2S2O3;
故答案为:4SO2+2Na2S+Na2CO3=CO2+3Na2S2O3;
(4)从上述生成物混合液中获得较高产率Na2S2O3?5H2O,在混合液中加入活性碳脱色,然后趁热过滤,防止溶液中Na2S2O3?5H2O析出,将除去碳后的滤液进行蒸发浓缩、冷却结晶、抽滤、洗涤、干燥,可得粗晶体,所以操作①趁热过滤,其目的是:趁热是为了防止晶体在过滤的过程中在漏斗中析出导致产率降低;过滤是为了除去活性炭、硫等不溶性杂质,操作②是蒸发浓缩,冷却结晶;
故答案为:为了防止晶体在漏斗中大量析出导致产率降低;蒸发浓缩,冷却结晶;
(5)淀粉溶液作指示剂,用度为0.500mol/LI2的标准溶液进行滴定溶液中的碘,滴定终点时溶液由无色变蓝色,且半分钟不褪色;
第二组实验数据相差较大,舍去,故消耗标准液的体积为(19.98+20.02)mL÷2=20.00mL,2S2O32-~I2,则n(Na2S2O3•5H2O)=2n(I2),故产品纯度为:$\frac{20.00mL×1{0}^{-3}×0.5mol/L×2×\frac{100mL}{10mL}×248g/mol}{6g}×100%$=82.67%;
故答案为:溶液由无色变蓝色,且半分钟不褪色;82.67%;
(6)Na2S2O3常用作脱氧剂,在溶液中易被Cl2氧化成SO42-,硫元素化合价升高,则氯元素化合价降低,生成氯离子,离子反应为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;
故答案为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+.
点评 本题考查实验方案方案,涉及仪器识别、对操作的分析评价、方程式书写、实验操作、化学计算等,侧重实验分析能力及知识综合应用能力的考查,题目难度中等


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯酚沾在手上应立即用酒精洗涤 | |
| B. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 | |
| C. | 点燃甲烷、乙烯等可燃性气体前必须先检验其纯度 | |
| D. | 在苯酚溶液中滴入少量稀溴水出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子组 | 加入试剂 | 离子方程式 | |
| A | Al3+、SO42- | 适量Ba(OH)2溶液 | Al3++3OH-═Al(OH)3↓ |
| B | Fe2+、I- | 足量新制氯水 | Cl2+2I-═2Cl-+I2 |
| C | Fe3+、NO3- | NaHSO3溶液 | 3SO32-+2NO3-+2H+═3SO42-+2NO↑+H2O |
| D | Ca2+、HCO3- | 氨水 | Ca2++2HCO3-+2NH3•H2O═CaCO3↓+CO32-+2NH4++2H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何可逆反应都有一定的限度 | |
| B. | 反应条件改变,化学反应限度可能改变 | |
| C. | 化学反应达到平衡时,正、逆反应速率一定相等 | |
| D. | 化学反应达到平衡时,所有物质的微粒均不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag2S | B. | NaCl | C. | Al | D. | NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向石蕊溶液中滴加氯水至足量 | 石蕊溶液先变红再褪色 | Cl2有酸性和漂白性 |
| B | 向大豆油、煤油中分别加入足量NaOH溶液,充分加热 | 一种液体仍然分层,另一种液体不再分层 | 分层者为煤油,不分层者为大豆油 |
| C | 向某溶液中加入足量盐酸 | 生成白色沉淀 | 该溶液中含有Ag+ |
| D | 用容量瓶配制一定物质的量浓度的K2SO4溶液,定容后反复摇匀 | 液面低于刻度线 | 所配溶液浓度偏高 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
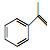 (异丙烯苯)$→_{一定条件}^{H+}$
(异丙烯苯)$→_{一定条件}^{H+}$ (异丙苯),下列说法错误的是( )
(异丙苯),下列说法错误的是( )| A. | 异丙苯的化学式为C9H12 | |
| B. | 该反应属于加成反应 | |
| C. | 异丙苯的一氯代物有5种 | |
| D. | 可用酸性KMnO4,溶液鉴别异丙烯苯和异丙苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .下列有关M的说法正确的是( )
.下列有关M的说法正确的是( )| A. | 1mol M与烧碱溶液反应时最多消耗2molNaOH | |
| B. | M不能使酸性KMnO4溶液褪色,但能发生取代反应 | |
| C. | M的分子式为C8H14O3 | |
| D. | M可通过加聚反应生成高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
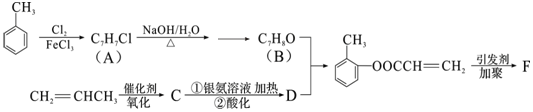
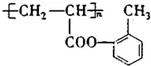
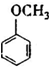 (填结构简式).
(填结构简式).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com