
| 选项 | 各种物质中的少量杂质 | 试剂 | 方法 |
| A | 苯中的溴 | NaOH溶液 | 分液 |
| B | 乙醇中的乙酸 | 浓硫酸 | 加热 |
| C | 乙酸乙酯中的乙酸 | NaOH溶液 | 分液 |
| D | 甲烷中混有乙烯 | 酸性KMnO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
科目:高中化学 来源: 题型:解答题
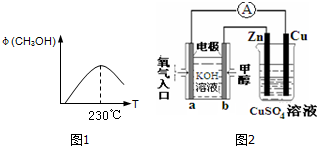
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |

| 实验次数 温度 | 起始温度t1/℃ | 终止温度t2/℃ | 平均温度差(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高分子化合物结构复杂,相对分子质量很大 | |
| B. | 对于一块高分子材料来说,n是一个整数,因而它的相对分子质量是确定的 | |
| C. | 高分子化合物是纯净物 | |
| D. | 高分子材料可分为天然高分子材料和合成高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅是制造太阳能电池的常用材料 | |
| B. | 光导纤维的主要成分是硅 | |
| C. | 用氢氟酸可以蚀刻玻璃 | |
| D. | 石灰石和粘土是制玻璃的主要原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH-12e-+12OH-═2CO2+9H2O | B. | O2+4H++4e-═2H2O | ||
| C. | O2+2H2O+4e-═4OH- | D. | C2H5OH+16OH--12e-═2CO32-+11H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- | |
| B. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| C. | 碳酸氢钠溶液中:K+、ClO-、Cl-、OH- | |
| D. | 使酚酞变红的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 对于mA(s)+nB(g)?pC(g)+Q的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
对于mA(s)+nB(g)?pC(g)+Q的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )| A. | m+n<p | B. | n>p | ||
| C. | x点的状态是v正>v逆 | D. | 以上答案都错误 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 用试管加热碳酸氢钠固体时使试管口竖直向上 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 做蒸馏实验时,如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com