
往100 mL FeCl3溶液中,通入0.672L标准状况下的硫化氢气体,设气体完全被吸收,再加入过量的铁粉,反应停止后,测得溶液中含有0.12mol金属阳离子,则原氯化铁溶液的物质的量浓度为
| A.0.1 mo/L | B.1 mo/L | C.0.08 mo/L | D.0.8 mo/L |
科目:高中化学 来源: 题型:
A.混合物里三种物质与盐酸反应时,消耗HCl的物质的量之比为1∶1∶3
B.反应后所得溶液中的Fe2+与Cl-的物质的量之比为1∶2
C.混合物里FeO的量无法确定,但Fe2O3的物质的量一定比Fe的物质的量多
D.混合物里Fe2O3的量无法确定,但Fe的物质的量一定比FeO的物质的量多
查看答案和解析>>
科目:高中化学 来源:2010—2011年江苏省盐城中学高一上学期期末考试化学卷 题型:实验题
(16分)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物,实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下: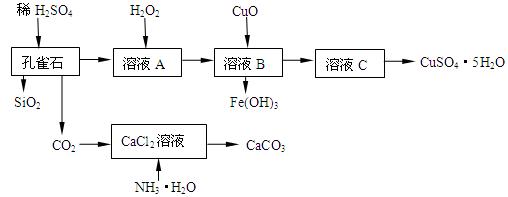
试回答下列问题:
(1)在未加入H2O2的溶液A中,存在的金属离子有Cu2+、Fe2+、Fe3+。若检验该溶液中Fe3+,选择最合适的试剂是 (填代号)。
| A.KMnO4溶液 | B.Fe粉 | C.Na2CO3溶液 | D.KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市奉贤区高三上学期期末教学质量调研化学试卷(解析版) 题型:计算题
镁、铝、铁及其化合物在生产和生活中有广泛的应用。
(1)镁铝合金用在飞机制造业,现有3.90克镁铝合金溶于足量的2mol/L稀硫酸中生成0.2mol氢气,计算并确定镁铝合金中物质的量n(Mg): n(Al)= 。
(2)硫铁矿的主要成分为FeS2(假设杂质只含SiO2)是生产硫酸的原料。取某硫铁矿10g在足量的空气中煅烧(4FeS2+11O2→2Fe2O3+8SO2),充分反应后冷却,称得固体质量为7.4g(杂质SiO2不反应)。该硫铁矿中FeS2的质量分数为 。
(3)现有一定量的铁粉和铝粉组成的混合物跟100 mL稀硝酸充分反应,反应过程中无任何气体放出,往反应后的澄清溶液中逐渐加入4.00 mol·L-1的NaOH溶液,加入NaOH溶液的体积与产生沉淀的质量的关系如图所示(必要时可加热,忽略气体在水中的溶解):纵坐标中A点的数值是 。

(4)炼铁厂生产的生铁常用于炼钢。取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况下)。
①计算此钢样粉末中铁和碳的物质的量之比为 (最简单的整数比)。
②再取三份不同质量的上述钢样粉末分别加到100mL相同浓度的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
|
实验序号 |
Ⅰ |
Ⅱ |
Ⅲ |
|
加入钢样粉末的质量(g) |
2.812 |
5.624 |
8.436 |
|
生成气体的体积(L)(标准状况) |
1.120 |
2.240 |
2.800 |
则该硫酸溶液的物质的量浓度为 。
③若在上述实验Ⅱ中继续加入m克钢样粉末,计算反应结束后剩余的固体质量为 g (保留3位小数)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省徐州市高三考前模拟化学试卷(解析版) 题型:计算题
铁及其化合物在国民经济的发展中起着重要作用。
(1)已知:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1641.0kJ·mol-1 C(石墨)+1/2O2(g)=CO(g) △H=-110.5 kJ·mol-1则Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)的△H= kJ·mol-1。
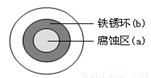
(2)铁在潮湿的空气中易发生电化学腐蚀。某同学将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。液滴边缘是 区(填“正极”或“负极”),其电极反应式为 。
(3)铁钛合金是一种常用的不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程中发生的反应有:
①2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
②Ti3+(紫色)+Fe3++H2O= TiO2+(无色)+Fe2++2H+
③ 。
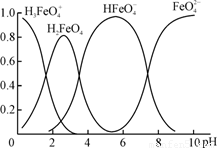
(4)①高铁酸钾(K2FeO4)是一种优良的水处理剂。FeO在水溶液中的存在形态如右图所示,纵坐标表示各存在形态的分数分布。
下列说法不正确的是 。(填字母)
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO+OH-=FeO+H2O
②K2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为 。
(5)向一定量的Fe、FeO、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)气体,加入KSCN溶液不显红色。若用足量的CO在高温下还原相同质量的此混合物,可得铁 g。
查看答案和解析>>
科目:高中化学 来源:2010-2011年江苏省高一上学期期末考试化学卷 题型:实验题
(16分)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物,实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
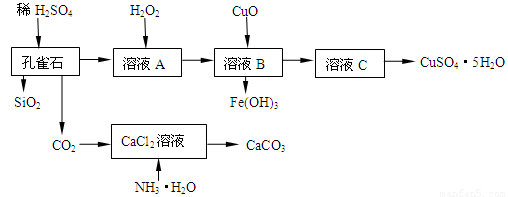
试回答下列问题:
(1)在未加入H2O2的溶液A中,存在的金属离子有Cu2+、Fe2+、Fe3+。若检验该溶液中Fe3+,选择最合适的试剂是 (填代号)。
A.KMnO4溶液 B.Fe粉 C. Na2CO3溶液 D.KSCN溶液
向溶液A中加入H2O2,H2O2在该反应中作氧化剂。实验室选用H2O2而不用Cl2作氧化剂。除考虑环保因素外,另一原因是不引入杂质 离子。
(2)由溶液C获得CuSO4·5H2O,需要经过加热浓缩, ,过滤等操作。除烧杯、漏斗外,过滤操作还需用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
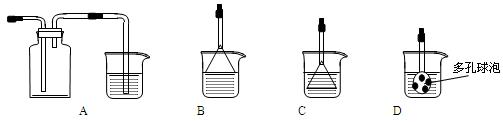
(3)制备CaCO3时,发生反应的化学方程式是 ;若实验过程中有氨气逸出,可选用下列装置中的 (填代号)装置吸收氨气。
(烧杯中的液体都为水)

(4)欲测定溶液A中Fe2+的浓度,需配制100 mL 0.1 mol∕LKMnO4标准溶液。配制该溶液时:除烧杯、玻璃棒、胶头滴管外,还需的一种玻璃仪器是 ;当往该玻璃仪器中加蒸馏水至接近刻度线1-2cm时,应改用 滴加蒸馏水至溶液的凹液面正好与刻度线相平。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com