
| 1.8 |
| Ksp |
| c(Ag+) |
| 1.8×10-10 |
| 0.3 |


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-4mol?L-1 | 3.00 | 2.25 | 1.75 | 1.36 | 1.00 | 1.00 |
| c(CO)/×10-4mol?L-1 | 4.00 | 3.25 | 2.75 | 2.36 | 2.00 | 2.00 |
| 实验编号 | T/℃ | NO初始浓度mpl?L-1 | CO初始浓度mpl?L-1 | 催化剂的比表面积m2?g-1 |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | a | 1.20×10-3 | c | 124 |
| Ⅲ | 350 | b | 5.80×10-3 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、488.3kJ?mol-1 |
| B、-244.15kJ?mol-1 |
| C、244.15kJ?mol-1 |
| D、-488.3kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
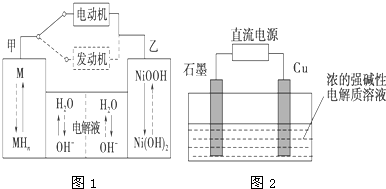 运用相关原理,回答下列问题:
运用相关原理,回答下列问题:| 1 |
| 2 |
| 3 |
| 2 |
| 放电 |
| 充电 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图装置,试管中盛有水,气球a中盛有干燥的Na2O2颗粒,U形管中注有浅红色的水,将气球用橡皮筋紧缚在试管口.实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )
如图装置,试管中盛有水,气球a中盛有干燥的Na2O2颗粒,U形管中注有浅红色的水,将气球用橡皮筋紧缚在试管口.实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )| A、U形管内红色退去 |
| B、试管内溶液变红 |
| C、气球a变瘪 |
| D、U形管水位d>c |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加过量KI溶液充分反应后,Ksp(AgCl)减小 |
| B、加过量KI溶液充分反应后,溶液中Ag+和I-的浓度之积等于Ksp(AgI) |
| C、加过量KI溶液充分反应后,溶液中Ag+和Cl-的浓度之积小于Ksp(AgCl) |
| D、Ksp(AgI)<Ksp(AgCl) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com