
| ||
|
| ||
|


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
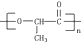 由一种单体缩聚而成的,该单体的结构简式为
由一种单体缩聚而成的,该单体的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率 (×10-3mol?L-1?min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| T/K | 673 | 773 | … |
| K | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.查看答案和解析>>
科目:高中化学 来源: 题型:
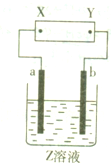 如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色、无臭气体放出.符合这一情况的是附表中的( )
如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色、无臭气体放出.符合这一情况的是附表中的( )| a极板 | b极板 | X电极 | Z溶液 | |
| A | 铂 | 石墨 | 负极 | CuSO4溶液 |
| B | 石墨 | 石墨 | 负极 | NaOH溶液 |
| C | 石墨 | 石墨 | 正极 | AgNO3溶液 |
| D | 铂 | 石墨 | 负极 | CuCl2溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com