
【题目】![]() 是重要的核工业原料。下列有关
是重要的核工业原料。下列有关![]() 、
、![]() 说法正确的是
说法正确的是
A. ![]() 原子核中含有92个中子 B.
原子核中含有92个中子 B. ![]() 原子核外有143个电子
原子核外有143个电子
C. ![]() 与
与![]() 互为同位素 D.
互为同位素 D. ![]() 与
与![]() 互为同素异形体
互为同素异形体
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一些杀菌、镇痛的药物可由植物的种子、根皮提炼得到,如丁香酚、丹皮酚,其结构如下:
请回答:
(1)丁香酚和丹皮酚都具有杀菌作用,其原因可能是含有(填官能团的名称).
(2)丁香酚和丹皮酚都能发生的反应类型为(填字母序号).
A.加成反应
B.加聚反应
C.取代反应
D.消去反应
(3)丁香酚发生聚合反应生成高分子的化学方程式为 . 丁香酚发生反应如下图所示.
已知: 
③丹皮酚在“一定条件”生成的物质与D互为同分异构体.
(4)丁香酚→A过程中加入NaOH溶液的原因是 .
(5)写出一种同时符合以下条件的D的同分异构体的结构简式: .
a.苯环上连接两种基团
b.遇FeCl3溶液显示特征颜色
c.能发生银镜反应
d.核磁共振氢谱显示含有五种氢原子
(6)D→E反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸苯甲酯( ![]() )广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精.已知:X的产量可以用来衡量一个国家的石油化工发展水平,工业上可用X和甲苯人工合成乙酸苯甲酯.其合成路线如下:
)广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精.已知:X的产量可以用来衡量一个国家的石油化工发展水平,工业上可用X和甲苯人工合成乙酸苯甲酯.其合成路线如下: 
据此回答下列问题:
(1)X生成Y的化学方程式为 , 生成物Y中含有官能团的名称为 .
(2)![]() 发生反应④所需的条件是 , 该反应的反应类型为 .
发生反应④所需的条件是 , 该反应的反应类型为 .
(3)实验室为鉴别A和B两者的水溶液,可以选用的化学试剂是 .
A.纯碱溶液
B.NaOH溶液
C.金属钠
D.银氨溶液
(4)上述反应①~⑤中原子的理论利用率为100%、符合绿色化学要求的反应是(填序号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同质量的SO2和SO3它们之间的关系是
A. 所含硫原子的物质的量之比为1:1
B. 氧原子的物质的量之比为3:2
C. 氧元素的质量比为5:6
D. 硫元素的质量比为4:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL0.1000molL﹣1的醋酸溶液中逐滴加入0.1000molL﹣1的NaOH溶液,pH随NaOH溶液体积的变化如图所示.下列说法不正确的是( ) 
A.在反应过程中始终,c(Na+)+c(H+)=c(CH3COO﹣)+c(OH﹣)
B.pH=4时,c(CH3COO﹣)>c(Na+)>c(H+)>c(OH﹣)
C.pH=6时,c(CH3COO﹣)+c(CH3COOH)=0.1000 molL﹣1
D.pH=7时,消耗NaOH溶液的体积小于20.00mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用无机矿物资源生产部分材料的流程示意图如下。下列说法正确的是( )
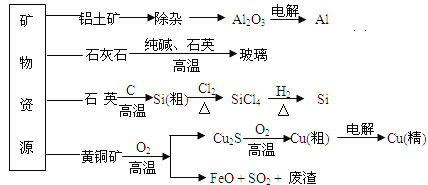
(注:铝土矿中含有A12O3、SiO2、Fe2O3)
A. 在铝土矿制备较高纯度A1的过程中只用到NaOH溶液、CO2气体、冰晶石
B. 石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应
C. 在制粗硅时,氧化剂与还原剂的物质的量之比为1∶2
D. 黄铜矿(CuFeS2)与O2反应产生的Cu2S、SO2均是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气及其相关产品是基本化工原料,在化工领域中具有重要的作用.
(1)以铁为催化剂,0.6mol氮气和1.8mol氢气在恒温、容积恒定为1L的密闭容器中反应生成氨气,20min后达到平衡,氮气的物质的量为0.3mol.
该反应体系未达到平衡时,增大压强对逆反应速率的影响是(填增大、减少或不变).
(2)①N2H4是一种高能燃料,有强还原性,可通过NH3和NaClO反应制得,写出该制备反应的化学方程式
②N2H4的水溶液呈弱碱性,室温下其电离常数K1=1.0×10﹣6 , 则0.01molL﹣1 N2H4水溶液的pH等于
(忽略N2H4的二级电离和H2O的电离).
③已知298K和101KPa条件下,32.0gN2H4在氧气中完全燃烧生成氮气和水,放出热量624kJ,则N2H4(l)的标准燃烧热的热化学方程式
(3)科学家改进了NO2转化为HNO3的工艺(如虚框所示),在较高的操作压力下,提高N2O4/H2O的质量比和O2的用量,能制备出高浓度的硝酸. ![]()
实际操作中,增大N2O4 , 对此请给出合理解释
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com