
 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
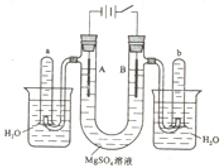
科目:高中化学 来源:不详 题型:填空题
 LiNiO2
LiNiO2
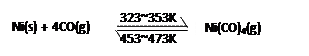 (3)Ni可以与CO(g)发生反应:
(3)Ni可以与CO(g)发生反应: A.低温区 B.高温区
A.低温区 B.高温区查看答案和解析>>
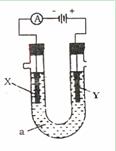
科目:高中化学 来源:不详 题型:单选题
| A.原溶液中溶质的质量为32g |
| B.电解过程中转移电子的物质的量为0.8mol |
| C.电解过程中阳极产生的气体在标准状况下的体积为4.48L |
| D.在相同条件下,阴极得到气体的体积大于阳极得到气体的体积 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a是正极 |
| B.a是负极 |
| C.Pt极上产生气体的物质的量是Fe极的2倍 |
| D.Q池CuSO4溶液溶质的质量分数不变 |
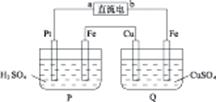
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
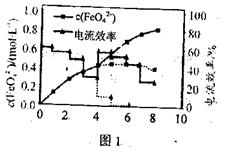
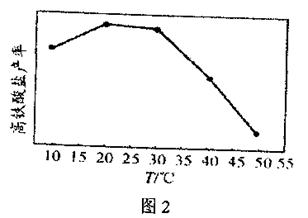
查看答案和解析>>
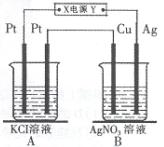
科目:高中化学 来源:不详 题型:单选题
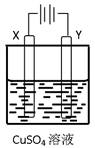
| | X电极 | Y电极 | 通电后的变化 |
| A | 石墨 | 石墨 | Y电极质量增加,溶液的pH增大 |
| B | 铁 | 铜 | 两电极的质量不发生变化 |
| C | 铜 | 铁 | X电极质量减小,Cu2+浓度不变 |
| D | 铁 | 铂 | Y电极:Fe2++2e-= Fe |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电镀时应把镀件置于电解槽的阳极 |
| B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小 |
| C.目前已经研制成功铝—空气电池,铝为电池的负极 |
| D.原电池的负极和电解池的阳极所发生的反应同属还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com