
| A. | 热的纯碱溶液去油污效果好 | |
| B. | 将TiCl4溶于大量水,同时加热,可得TiO2 | |
| C. | 用Na2CO3溶液和盐酸处理水垢中的CaSO4 | |
| D. | FeCl3溶液加热后颜色变深 |
分析 A.盐类水解是吸热反应,升高温度促进水解;
B、TiCl4溶于大量水,钛离子水解得到沉淀,加热会分解得到二氧化钛;
C、Na2CO3溶液中的碳酸根离子可以和硫酸钙中的钙离子反应,转化为碳酸钙沉淀,碳酸钙可以和盐酸之间反应生成可溶的氯化钙、水以及二氧化碳;
D、FeCl3溶液中铁离子水解得到氢氧化铁,受热会促进水解反应的进行.
解答 解:A.热的纯碱溶液中碳酸根离子水解是吸热反应,升高温度促进水解,碱性增强,去油污效果好,和盐类水解有关,故A不选;
B、TiCl4溶于大量水,钛离子水解得到沉淀,加热会分解得到二氧化钛,与盐类水解有关,故B不选;
C、Na2CO3溶液中的碳酸根离子可以和硫酸钙中的钙离子反应,转化为碳酸钙沉淀,碳酸钙可以和盐酸之间反应生成可溶的氯化钙、水以及二氧化碳,属于沉淀的转化原理的应用,与盐类水解无关,故C选;
D、FeCl3溶液中铁离子水解得到氢氧化铁,受热会促进水解反应的进行,得到氢氧化铁沉淀,即加热后颜色变深,和盐类水解有关,故D不选.
故选C.
点评 本题考查了盐的水解原理、水解平衡移动等知识,题目难度不大,注意把握盐的水解原理及其应用是关键.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | 用HNO2溶液做导电试验,灯光较暗 | |
| B. | HNO2是共价化合物 | |
| C. | 亚硝酸不与氯化钠反应 | |
| D. | 常温下0.1mol/L亚硝酸溶液的氢离子约为0.01mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成1molCu,转移2mol电子 | B. | Cu是氧化产物 | ||
| C. | Cu2S既是氧化剂又是还原剂 | D. | 氧化剂只有Cu2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①②⑤ | C. | ②③⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
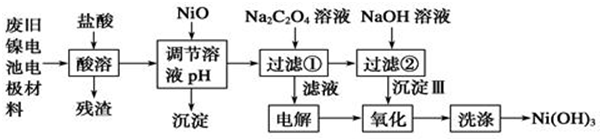
| Ksp | 开始沉淀pH | 沉淀完全pH | |
| Al(OH)3 | 1.9×10-33 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
| NiC2O4 | 4.0×10-10 | -- | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
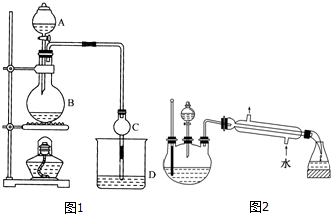
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应物是体积比1:3的乙醇和3mol/L硫酸的混和液 | |
| B. | 温度计插入反应溶液液面以下,以便控制反应温度 | |
| C. | 反应容器烧瓶中应加入少许瓷片 | |
| D. | 反应完毕先灭熄灭酒精灯,再从水槽中取出导管 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com