
①分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题:
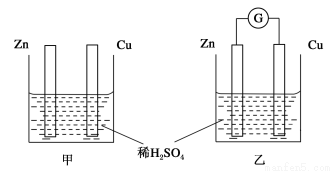
(1)以下叙述中,正确的是__________。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
(2)变化过程中能量转化的形式主要是:甲为__________;乙为__________。
(3)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式:
_____________________________________________________________
②(4分)氢氧燃料电池,是一种高效无污染的清洁电池它分碱性(用KOH做电解质)和酸性(用硫酸做电解质)氢氧燃料电池,
(1)如果是碱性燃料电池则负极反应方程式是: .
(2)如果是酸性燃料电池则负极反应方程式是: .
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源:2015-2016学年湖南省高一下期中文科化学试卷(解析版) 题型:选择题
化学反应伴随着能量的变化。下列过程中的能量变化不是由化学反应引起的是
A.天然气燃烧 B.中和反应
C.冰的融化 D.Ba(OH)2·8H2O晶体与NH4Cl晶体的充分反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二下期中化学试卷(解析版) 题型:填空题
本题为《化学与生活(选修1)》选做题,
(一)“北京烤鸭”举世闻名。制作烤鸭套餐的部分原料如下:① 鸭肉、② 面粉、③ 黄瓜、④ 食盐。请回答:
(1)富含淀粉的是 (填序号,下同)。(2)富含蛋白质的是 。
(3)富含维生素的是 。 (4)属于调味剂的是 。
(二).材料是人类赖以生存和发展的重要物质基础。
(1)试管、烧杯和烧瓶等化学仪器的主要材质是 ;
A.玻璃 B.陶瓷
(2)钢铁是目前用量最大的铁合金。钢铁接触海水发生电化学腐蚀,其负极反应式为 ;
A.O2+2H2O + 4e- = 4OH- B.Fe - 2e -= Fe2+
(三)含汞废水主要来源于氯碱工业和塑料工业,未经处理不得排放。某含汞酸性废水(主要含Hg2+、H+、Na+、Cl-等)的处理工艺流程如下图所示。
 请回答:
请回答:
(1)含汞废水未经处理直接排放的危害是 (填字母)。
a. 造成水体污染 b. 引起人体中毒
(2)调节废水pH时加入的溶液A可能是 (填字母)。
a. 盐酸 b. NaOH溶液
(3)Na2S与Hg2+发生反应的离子方程式是 。
(4)该废水经处理后,测得有关数据如下(其他离子忽略不计):
离子 | Na+ | Fe2+ | Cl- | SO42- |
浓度(mol/L) | 3.0×10-4 | 2.0×10-4 | 2.5×10-4 |
则c(Fe2+) = mol/L。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二下期中化学试卷(解析版) 题型:选择题
钴( )是一种穿透力很强的核辐射元素,可用来治疗癌症。下列关于
)是一种穿透力很强的核辐射元素,可用来治疗癌症。下列关于 的说法不正确的是( )
的说法不正确的是( )
A.钴的一种核素 B.质子数为27 C.核外电子数为27 D.中子数为60
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下期中化学试卷(解析版) 题型:选择题
一定条件下,可逆反应X(g) + 3Y(g) 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
A.c1:c2 = 1:3
B.当4v(X)正= v(Y)逆 时,该反应还在向逆反应方向建立平衡
C.X、Y的转化率不相等
D.Y起始浓度c2可能为0.36mol/L
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下期中化学试卷(解析版) 题型:选择题
下列叙述中正确的是
A.除零族元素外,短周期元素的最高化合价在数值上等于该元素所属的族序数
B.元素周期表有7个主族、7个副族、1个0族、1个Ⅷ族,共16个纵行
C.除短周期外,其他周期均有18种元素
D.在元素周期表的金属和非金属分界线附近寻找半导体材料
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省赣州市十三县(市)高二下期中化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
①pH=0的溶液:Na+、C2O42﹣、MnO4﹣、SO42﹣
②pH=11的溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣、S2﹣、SO32﹣
③水电离的H+浓度c(H+)=10﹣12 mol·L﹣1的溶液中: Cl﹣、CO32﹣、NO3﹣、NH4+、SO32﹣
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl﹣、K+、SO42﹣
⑤使石蕊变红的溶液中:Fe2+、MnO4﹣、NO3﹣、Na+、SO42﹣
⑥中性溶液中:Fe3+、Al3+、NO3﹣、I﹣、Cl﹣、S2﹣.
A.①③⑤ B.②③⑥ C.②④ D.①④⑤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省娄底市双峰县高一下期中化学试卷(解析版) 题型:填空题
在1×105Pa和298K时,将1mol气态AB分子分离成气态A原子和B原子所需要的能量成为键能(kJ•mol-1).下面是一些共价键的键能:(已知氨分子中有三个等价的氮氢共价键)
共价键 | H2分子 | N2分子 | NH3分子 |
键能(KJ.mo1-1) | 436 | 945 | 391 |
(1)根据上表中的数据判断工业合成氨的反应是______(填“吸热”或“放热”)反应;
(2)在298K时,取1mol氮气和3mol氢气放入一密闭容器中,在催化剂存在下进行反应.理论上放出或吸收的热量为Q1,则Q1为______KJ。
(3)实际生产中,放出或吸收的热量为Q2,Q1与Q2比较,正确的是___________
A.Q1 〉Q2 B.Q1〈 Q2 C.Q1 = Q2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com