

| A. | 铁锅生锈过程中有原电池反应,负极反应式是:Fe-2e-=Fe2+ | |
| B. | 铁锅生锈过程中有Fe(OH)3生成:Fe3++3H2O?Fe(OH)3+3H+ | |
| C. | 摄入体内的铁锈会在胃内产生不利于健康的Fe3+:Fe2O3+6H+═2Fe3++3H2O | |
| D. | 用醋可除去铁锈:6CH3COOH+Fe2O3═6CH3COO-+2Fe3++3H2O |
分析 A.生铁中铁、碳形成原电池,铁做负极发生氧化反应;
B.铁锅生锈为铁失去电子发生氧化反应;
C.铁锈为氧化铁,氧化铁与盐酸反应生成三价铁离子;
D.醋酸为弱酸,能够与氧化铁反应生成可溶性醋酸铁.
解答 解:A.生铁中铁、碳形成原电池,铁做负极发生氧化反应,电极反应式为Fe-2e-=Fe2+,故A正确;
B.铁锅生锈的实质为铁失去电子发生氧化反应,故B错误;
C.铁锈为氧化铁,氧化铁与盐酸反应生成三价铁离子,离子方程式:Fe2O3+6H+═2Fe3++3H2O,故C正确;
D.醋酸为弱酸,能够与氧化铁反应生成可溶性醋酸铁,离子方程式:6CH3COOH+Fe2O3═6CH3COO-+2Fe3++3H2O,故D正确;
故选:B.
点评 本题考查了金属的腐蚀与防护,明确金属腐蚀的原理是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在标准情况下,22.4LH2O含有的分子数为NA | |
| B. | 1L 0.1 mol?L-1的MgCl2溶液中含Mg2+的数目为0.1NA | |
| C. | 17.6g丙烷中所含的共价键数目为4NA | |
| D. | 20 ml 2mol?L-1 H2O2完全分解,转移的电子数为0.08NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与铝反应放出氢气的溶液中:Na+、Cl-、S2-、SO32- | |
| B. | c(HCO3-)=0.1mol•L-1的溶液中:Na+、K+、CO32-、Br- | |
| C. | 在由水电离出的c(OH-)=10-18 mol•L-1的溶液中Na+、Mg2+、NO3-、I- | |
| D. | 在能使pH试纸变深蓝色的溶液中:Na+、S2-、CO32-、NO3-、 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 107 g Fe(OH)3胶体中胶体粒子的数目为NA | |
| B. | 2molSO2与1molO2反应生成的SO3分子数为2NA | |
| C. | 14g分子式为CnH2n的链烃中含有的碳碳双键的数目为$\frac{{N}_{A}}{n}$ | |
| D. | 7.8 g Na2O2与足量水反应转移的电子散为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将 lmolCl2通入到水中,则n(HClO)+n(Cl-)+n(ClO-)=2NA | |
| B. | 常温常压下,17g甲基(-14CH3)中所含的中子数为9NA | |
| C. | 含NA个阴离子的Na2O2溶于水形成1L溶液,Na+浓度为1 mol•L-1 | |
| D. | 某温度时,1LpH=6.5的纯水中含有1.0×10-6.5NA个H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
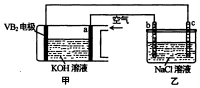 碱性硼化钒--空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5,室温下用该电池为电源,用惰性电极电解饱和氯化钠溶液,装置如图.当外电路中通过0.04mol电子时,乙装置中溶液的体积为400mL.则下列说法正确的是( )
碱性硼化钒--空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5,室温下用该电池为电源,用惰性电极电解饱和氯化钠溶液,装置如图.当外电路中通过0.04mol电子时,乙装置中溶液的体积为400mL.则下列说法正确的是( )| A. | 外电路中电子由a电极流向b电极 | |
| B. | 电极上生成气体的体积为4.48L | |
| C. | 乙装置中溶液的pH为13 | |
| D. | VB2电极发生的电极反应为:VB2+11H2O-22e-=VB2+2B2O3+22H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应过程中既有物质变化又有能量变化,能量的释放或吸收以物质变化为基础 | |
| B. | 研究化学反应进行的方向、快慢和限度是化学反应原理的重要内容 | |
| C. | Ag+和Cl-在水溶液中的反应瞬间发生,是因为这类反应活化能接近于零 | |
| D. | 能源就是能提供能量的资源,天然气、风能、水能都是可再生能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1 mol氦气含有的核外电子数为2NA | |
| B. | 1.7gCH5+离子中含有的电子总数为NA | |
| C. | lmolC10H22分子中共价键总数为31 NA | |
| D. | lmolNO2与足量水反应时共转移2NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com