
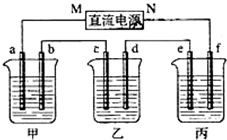
 ČēĶ¼ĖłŹ¾×°ÖĆÖŠ£¬¼×”¢ŅŅ”¢±ūČżøöÉÕ±ŅĄ“Ī·Ö±šŹ¢·Å100g 5.00%µÄNaOHČÜŅŗ”¢×ćĮæµÄCuSO4ČÜŅŗŗĶ100g 10.00%µÄK2SO4ČÜŅŗ£¬µē¼«¾łĪŖŹÆÄ«µē¼«£®
ČēĶ¼ĖłŹ¾×°ÖĆÖŠ£¬¼×”¢ŅŅ”¢±ūČżøöÉÕ±ŅĄ“Ī·Ö±šŹ¢·Å100g 5.00%µÄNaOHČÜŅŗ”¢×ćĮæµÄCuSO4ČÜŅŗŗĶ100g 10.00%µÄK2SO4ČÜŅŗ£¬µē¼«¾łĪŖŹÆÄ«µē¼«£®·ÖĪö £Ø1£©¢ŁŅŅÖŠCµē¼«ÖŹĮæŌö¼Ó£¬¼“C“¦ĪŖŅõ¼«£¬ÓÉ“ĖæÉĶĘ³öbĪŖŃō¼«£¬aĪŖŅõ¼«£¬MĪŖøŗ¼«£¬NĪŖÕż¼«£»
¢Ś¼×ÖŠĪŖNaOH£¬Ļąµ±ÓŚµē½āH2O£¬Ńō¼«b“¦ĪŖŅõĄė×ÓOH-·Åµē£¬¼“4OH--4e-=2H2O+O2”ü£»
¢Ū±ūŹµÖŹŹĒµē½āĖ®£¬µē½ā4.5gĖ®×ŖŅʵē×ÓĪļÖŹµÄĮæĪŖ0.5mol£¬øł¾Ż¹ŲĻµŹ½¼ĘĖćŃõĘųµÄĢå»ż£»
¢Üµē¼«cµÄ·“Ó¦ŹĒCu2++2e-=Cu£¬øł¾Ż×ŖŅĘ0.5molµē×Ó¼ĘĖćĶµÄÖŹĮ棻
¢Ż±ūÖŠĪŖµē½āĖ®£¬¶ŌÓŚK2SO4¶ųŃŌ£¬ĘäpH¼øŗõ²»±ä£»
£Ø2£©ĶČ«²æĪö³ö£¬æÉŅŌ¼ĢŠųµē½āH2SO4£¬ÓŠµē½āŅŗ¼“æɵē½ā£®
½ā“š ½ā£ŗ£Ø1£©¢Łµē½ā¹ż³ĢÖŠ£¬ŅŅ×°ÖĆŅõ¼«ÉĻCu2+·ÅµēÉś³ÉCu”¢Ńō¼«ÉĻH2OµĆµē×ÓÉś³ÉŃõĘųĶ¬Ź±Éś³ÉH+£¬ŅŅÖŠcµē¼«ÖŹĮæŌö¼Ó£¬ĖµĆ÷cĪŖŅõ¼«£¬ŌņdĪŖŃō¼«£¬øł¾Żµē½ā³Ų“®ĮŖµēĀ·ÖŖ£¬aceŹĒŅõ¼«”¢bdfŹĒŃō¼«£¬Į¬½Óµē½ā³ŲŃō¼«µÄµē¼«ŹĒµēŌ“Õż¼«£¬ĖłŅŌNĮ¬½Óµē½ā³ŲŃō¼«£¬ĪŖŌµē³ŲÕż¼«£¬¹Ź“š°øĪŖ£ŗÕż£»
¢Ś¼×µē½ā¹ż³ĢÖŠ£¬aŹĒŅõ¼«”¢bŹĒŃō¼«£¬Ņõ¼«ÉĻĖ®µĆµē×ÓÉś³ÉĒāĘųŗĶOH-£¬bµē¼«ÉĻOH-·ÅµēÉś³ÉŃõĘų£¬µē¼«·“Ó¦Ź½ĪŖ4OH--4e-=2H2O+O2”ü£¬
¹Ź“š°øĪŖ£ŗ4OH--4e-=2H2O+O2”ü£»
¢Ū±ūŹµÖŹŹĒµē½āĖ®£¬µē½ā4.5gĖ®×ŖŅʵē×ÓĪļÖŹµÄĮæ=$\frac{4.5g}{18g/mol}$=0.5mol£¬bµē¼«·“Ó¦Ź½ĪŖ4OH--4e-=2H2O+O2”ü£¬øł¾Ż×ŖŅʵē×ÓŹŲŗćµĆŃõĘųĢå»żĪŖ$\frac{0.5mol}{4}$”Į22.4L/mol=2.8L£¬¹Ź“š°øĪŖ£ŗ2.8L£»
¢ÜŅŅÖŠcµē¼«ÉĻĪö³öCu£¬Īö³öĶµÄÖŹĮæĪŖµē¼«ÖŹĮæ±ä»Æ£¬Õūøö¹ż³Ģ×ŖŅʵē×ÓĪŖ0.5mol£¬øł¾Żµē×Ó×ŖŅĘŹŲŗć£¬Īö³ön£ØCu£©=$\frac{0.5mol}{2}$=0.25mol£¬Ōņm£ØCu£©=0.25mol”Į64g/mol=16g£¬¹Ź“š°øĪŖ£ŗ16£»
¢Ż±ūŹĒµē½āĖ®£¬ĮņĖį¼ŲŹĒĒæĖįĒæ¼īŃĪ£¬ČÜŅŗ³ŹÖŠŠŌ£¬µē½ā¹ż³ĢÖŠĮņĖį¼ŲµÄĪļÖŹµÄĮæ²»±ä”¢ČÜŅŗĢå»ż¼õŠ”£¬ĖłŅŌĘäČÜŅŗĪļÖŹµÄĮæÅضČŌö“󣬵«ČÜŅŗČŌČ»³ŹÖŠŠŌ£¬ČÜŅŗĖį¼īŠŌ²»±ä£¬¹Ź“š°øĪŖ£ŗ²»±ä£»ŅņĪŖĻąµ±ÓŚµē½āĖ®£»
£Ø2£©Čē¹ūµē½ā¹ż³ĢÖŠĶČ«²æĪö³ö£¬ČÜŅŗÖŠČÜÖŹÓÉĮņĖįĶ×Ŗ»ÆĪŖĮņĖį£¬ČÜŅŗÖŠŗ¬ÓŠ×ŌÓÉŅĘ¶ÆĄė×Ó£¬ĮņĖįÄÜŌö“óČÜŅŗµ¼µēŠŌ£¬ĖłŅŌČŌČ»ÄܽųŠŠµē½ā£¬
¹Ź“š°øĪŖ£ŗÄÜ£»ŅņĪŖCuSO4ČÜŅŗŅŃ×Ŗ±äĪŖH2SO4ČÜŅŗ£¬·“Ó¦Ņ²¾Ķ±äĪŖµē½āĖ®µÄ·“Ó¦£®
µćĘĄ ±¾Ģāæ¼²éµē½āŌĄķ£¬ĪŖøßĘµæ¼µć£¬²ąÖŲæ¼²éѧɜ·ÖĪöÅŠ¶Ļ¼°¼ĘĖćÄÜĮ¦£¬Ć÷Č·µē¼«Ćū³Ę¼°ø÷øöµē¼«ÉĻ·¢ÉśµÄµē¼«·“Ó¦Ź½ŹĒ½ā±¾Ģā¹Ų¼ü£¬“®ĮŖµēĀ·ÖŠø÷øöµē¼«ÉĻ×ŖŅʵē×ÓŹżĻąµČ£¬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 4 | B£® | 3 | C£® | 2 | D£® | 1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | “×ĖįŗĶŠæ·“Ó¦·Å³öµÄĒāĘų¶ą | |
| B£® | ŃĪĖįŗĶ“×Ėį·Ö±šÓėŠæ·“Ó¦·Å³öµÄĒāĘųŅ»Ńł¶ą | |
| C£® | “×ĖįŗĶŠæ·“Ó¦ĖŁĀŹ½Ļ“ó | |
| D£® | ŃĪĖįŗĶ“×Ėį·Ö±šÓėŠæ·“Ó¦ĖŁĀŹŅ»Ńł“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŃĪĖįÓėĒāŃõ»ÆÄĘČÜŅŗµÄ·“Ó¦ | B£® | ÉśŹÆ»ŅŗĶĖ®µÄ·“Ó¦ | ||
| C£® | ĒāĘųŌŚøßĪĀĻĀÓėŃõ»ÆĶµÄ·“Ó¦ | D£® | ľĢæŌŚŃõĘųÖŠČ¼ÉÕ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | X Óė Y Ö»ÄÜŠĪ³ÉŅ»ÖÖ»ÆŗĻĪļ | |
| B£® | µ„ÖŹµÄŃõ»ÆŠŌ£ŗX£¼M | |
| C£® | ĘųĢ¬Ēā»ÆĪļµÄĪČ¶ØŠŌ£ŗM£¾N | |
| D£® | ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļµÄ¼īŠŌ£ŗY£¾Z |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
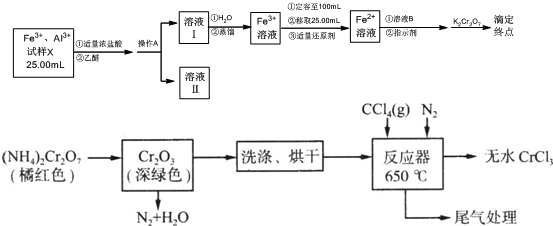
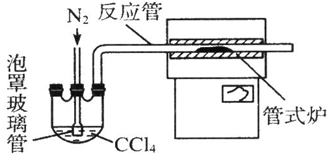
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 ¢ÜH2O¢ŻNH3£®
¢ÜH2O¢ŻNH3£®| A£® | ¢Ż¢Ü¢Ū¢Ś¢Ł | B£® | ¢Ü¢Ż¢Ś¢Ū¢Ł | C£® | ¢Ś¢Ż¢Ü¢Ū¢Ł | D£® | ¢Ł¢Ū¢Ś¢Ż¢Ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
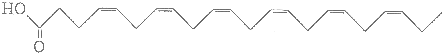
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ŅŃÖŖ£ŗÓŠ»śĀČ»Æ¼Į»Ēõ£ĀČSO2Cl2µÄÖĘ·Ø£ŗSO2£Øg£©+Cl2£Øg£©?SO2Cl2£Øg£©”÷H£¼0
ŅŃÖŖ£ŗÓŠ»śĀČ»Æ¼Į»Ēõ£ĀČSO2Cl2µÄÖĘ·Ø£ŗSO2£Øg£©+Cl2£Øg£©?SO2Cl2£Øg£©”÷H£¼0| c£ØSO2£©/mol•L-1 | c£ØCl2£©/mol•L-1 | v/mol•L-1•S-1 |
| 1.0 | 1.0 | 1.0k |
| 2.0 | 1.0 | 2.0k |
| 2.0 | 4.0 | 8.0k |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com