
【题目】A、B、C、D、E、F代表周期表中五种短周期元素,已知:
![]() 、B、C处于相邻位置,B、C同周期,A、B同主族,其核外电子数之和为41。
、B、C处于相邻位置,B、C同周期,A、B同主族,其核外电子数之和为41。
![]() 与C处于周期表中同一周期,
与C处于周期表中同一周期,![]() 中各层电子数都是
中各层电子数都是![]() 个。
个。
![]() 、B、C、D、E各元素最外层电子数之和24,且已知E与A只能形成一种化合物。
、B、C、D、E各元素最外层电子数之和24,且已知E与A只能形成一种化合物。
![]() 是半径最小的原子。据此填空下列空白:
是半径最小的原子。据此填空下列空白:
![]() 写出各元素的名称A ______ C ______ E ______
写出各元素的名称A ______ C ______ E ______
![]() 写出A和D形成化合物的电子式 ______
写出A和D形成化合物的电子式 ______
![]() 、C、D三种元素单原子离子的半径由大到小的顺序: ______
、C、D三种元素单原子离子的半径由大到小的顺序: ______
![]() 、B的氢化物的熔沸点大小并写出原因: ______
、B的氢化物的熔沸点大小并写出原因: ______
![]() 写出A与B组成的化合物与C单质水溶液反应的化学方程式: ______ 。
写出A与B组成的化合物与C单质水溶液反应的化学方程式: ______ 。
【答案】氧 氯 硅 ![]()
![]()
![]()
![]() ;水中有氢键
;水中有氢键 ![]()
【解析】
A、B、C、D、E代表周期表中五种短周期元素,![]() 中各层电子数都是
中各层电子数都是![]() 个,且为短周期元素,则D是Na元素,C和D处于同一周期、B和C同一周期,则B、C都位于第三周期,A和B同一主族,则A位于第二周期,A、B、C处于相邻位置,A、B、C核外电子数之和为41,设A原子序数是
个,且为短周期元素,则D是Na元素,C和D处于同一周期、B和C同一周期,则B、C都位于第三周期,A和B同一主族,则A位于第二周期,A、B、C处于相邻位置,A、B、C核外电子数之和为41,设A原子序数是![]() 为正整数
为正整数![]() ,则B原子序数为
,则B原子序数为![]() ,C原子序数为为
,C原子序数为为![]() 或
或![]() ,
,![]() ,则
,则![]() 舍去
舍去![]() ,
,![]() ,
,![]() ,则A是O元素、B是S元素、C是Cl元素,A、B、C、D、E各元素最外层电子数之和24,则E最外层电子数
,则A是O元素、B是S元素、C是Cl元素,A、B、C、D、E各元素最外层电子数之和24,则E最外层电子数![]() ,E与A只能形成一种化合物,则E是Si元素;F是半径最小的原子,应为H元素。
,E与A只能形成一种化合物,则E是Si元素;F是半径最小的原子,应为H元素。
![]() 由以上分析可知A为氧,C为氯,E为硅。
由以上分析可知A为氧,C为氯,E为硅。
![]() 和D形成化合物为过氧化钠、氧化钠。
和D形成化合物为过氧化钠、氧化钠。
![]() 电子层越多离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小。
电子层越多离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小。
![]() 水中含有氢键,较一般分子间作用力强。
水中含有氢键,较一般分子间作用力强。
![]() 、B形成的化合物是二氧化硫,C单质是氯气,二氧化硫和氯气在水溶液中发生氧化还原反应生成硫酸和HCl。
、B形成的化合物是二氧化硫,C单质是氯气,二氧化硫和氯气在水溶液中发生氧化还原反应生成硫酸和HCl。
A、B、C、D、E代表周期表中五种短周期元素,![]() 中各层电子数都是
中各层电子数都是![]() 个,且为短周期元素,则D是Na元素,C和D处于同一周期、B和C同一周期,则B、C都位于第三周期,A和B同一主族,则A位于第二周期,A、B、C处于相邻位置,A、B、C核外电子数之和为41,设A原子序数是
个,且为短周期元素,则D是Na元素,C和D处于同一周期、B和C同一周期,则B、C都位于第三周期,A和B同一主族,则A位于第二周期,A、B、C处于相邻位置,A、B、C核外电子数之和为41,设A原子序数是![]() 为正整数
为正整数![]() ,则B原子序数为
,则B原子序数为![]() ,C原子序数为为
,C原子序数为为![]() 或
或![]() ,
,![]() ,则
,则![]() 舍去
舍去![]() ,
,![]() ,
,![]() ,则A是O元素、B是S元素、C是Cl元素,A、B、C、D、E各元素最外层电子数之和24,则E最外层电子数
,则A是O元素、B是S元素、C是Cl元素,A、B、C、D、E各元素最外层电子数之和24,则E最外层电子数![]() ,E与A只能形成一种化合物,则E是Si元素;F是半径最小的原子,应为H元素。
,E与A只能形成一种化合物,则E是Si元素;F是半径最小的原子,应为H元素。
![]() 由以上分析可知A为氧,C为氯,E为硅。答案为:氧;氯;硅;
由以上分析可知A为氧,C为氯,E为硅。答案为:氧;氯;硅;
![]() 和D形成化合物分别为过氧化钠、氧化钠,其电子式可分别表示为
和D形成化合物分别为过氧化钠、氧化钠,其电子式可分别表示为![]() 、
、![]() ;
;
![]() 电子层越多离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,B、C、D离子分别是
电子层越多离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,B、C、D离子分别是![]() 、
、![]() 、
、![]() ,硫离子和氯离子有3个电子层、钠离子有2个电子层,所以离子半径大小顺序是
,硫离子和氯离子有3个电子层、钠离子有2个电子层,所以离子半径大小顺序是![]() 。答案为:
。答案为:![]() ;
;
![]() 水中含有氢键,较一般分子间作用力强,水的沸点较高。答案为:
水中含有氢键,较一般分子间作用力强,水的沸点较高。答案为:![]() ;水中有氢键;
;水中有氢键;
![]() 、B形成的化合物是二氧化硫,C单质是氯气,二氧化硫和氯气在水溶液中发生氧化还原反应生成硫酸和HCl,反应方程式为
、B形成的化合物是二氧化硫,C单质是氯气,二氧化硫和氯气在水溶液中发生氧化还原反应生成硫酸和HCl,反应方程式为![]() 。答案为:
。答案为:![]() 。
。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】下表是某学生为探究AgCl沉淀转化为![]() 沉淀的反应所做实验的记录.
沉淀的反应所做实验的记录.
步骤 | 现象 |
Ⅰ | 立即产生白色沉淀 |
Ⅱ | 沉淀迅速变为黑色 |
Ⅲ | 较长时间后,沉淀变为乳白色 |
Ⅳ | 产生红棕色气体,沉淀部分溶解 |
Ⅴ | 产生白色沉淀 |
![]() 为了证明沉淀变黑是AgCl转化为
为了证明沉淀变黑是AgCl转化为![]() 的缘故,步骤I中NaCl溶液的体积范围为 ______ 。
的缘故,步骤I中NaCl溶液的体积范围为 ______ 。
![]() 已知:
已知:![]() 时
时![]() ,
,![]() ,此沉淀转化反应的平衡常数
,此沉淀转化反应的平衡常数![]() ______。
______。
![]() 步骤V中产生的白色沉淀的化学式为 ______ ,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有 ______。
步骤V中产生的白色沉淀的化学式为 ______ ,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有 ______。
![]() 为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置。
为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置。
![]() 装置A中玻璃仪器有圆底烧瓶、导管和 ______ ,试剂W为 ______ 。
装置A中玻璃仪器有圆底烧瓶、导管和 ______ ,试剂W为 ______ 。
![]() 装置C中的试剂为NaCl溶液和
装置C中的试剂为NaCl溶液和![]() 悬浊液的混合物,B中试剂为 ______ 。
悬浊液的混合物,B中试剂为 ______ 。
![]() 实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化。
实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化。
完成C中反应的化学方程式:______Ag2S+_____NaCl+______ + ______ AgCl+S+ ______
______
C中NaCl的作用是: ______ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明在研究元素时发现,可以将前18号元素排成如图所示的“蜗牛”形状,图中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是

A. 虚线相连的元素处于同一族,A元素位于元素周期表ⅥA族
B. 离O点越远的元素原子半径一定越大
C. B、C最高价氧化物的水化物可以相互反应
D. B元素是图中金属性最强的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一定量的铁与足量稀硫酸及足量的氧化铜制单质铜,设计了以下两种方案:
先用铁与稀硫酸反应产生氢气,再用氢气还原氧化铜得到单质铜;
先用稀硫酸溶解氧化铜得到硫酸铜溶液,再与铁发生置换反应得到单质铜。
若按实验原则进行操作,则两者制得单质铜的质量( )
A.一样多
B.①多
C.②多
D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,等体积的氨水和KOH两种溶液,其![]() ,下列说法正确的是
,下列说法正确的是![]()
A.![]() 的浓度小于KOH
的浓度小于KOH
B.分别向两溶液中加入盐酸完全中和后,溶液中水的电离程度前者大于后者
C.两溶液加水稀释过程中 、
、 均增大
均增大
D.分别加水稀释相同倍数后,溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热N2O5,依次发生的分解反应:①N2O5(g)![]() N2O3(g)+O2(g),②N2O3(g)
N2O3(g)+O2(g),②N2O3(g)![]() N2O(g)+O2(g);在体积为2L密闭容器中充入8molN2O5,加热到t℃,达到平衡状态。此时O2为9mol, N2O3为3.4mol。则t℃时反应①的平衡常数为
N2O(g)+O2(g);在体积为2L密闭容器中充入8molN2O5,加热到t℃,达到平衡状态。此时O2为9mol, N2O3为3.4mol。则t℃时反应①的平衡常数为
A. 10.7 B. 8.5 C. 9.6 D. 10.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10mLNaOH溶液中逐滴加入0.lmol/L的HR溶液,测得反应混合液中c水(OH-)与V(HR)的变化关系如图所示。下列说法不正确的是

A. V2=10
B. HR为弱酸
C. 当V(HR)=V2时,溶液中存在:c (OH-)-c(H+)=c(HR)
D. 当V(HR)=V1或V3时,溶液中均有:c(Na+)=c(HR)+c(R-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A在一定条件下可以转化为有机物E,其转化关系如下图。已知烃A在标准状况下的密度为116g/L,加热时B与新制氢氧化铜产生砖红色沉淀,E为有浓郁香味、不易溶于水的油状液体。
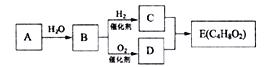
请回答:
(1)B中官能团的结构简式为_________________________。
(2)C+D→E的化学方程式为___________________________________。
(3)下列说法正确的是______
a.C物质与金属钠反应比水与金属钠反应更剧烈
b.有机物C、D、E可用饱和Na2CO3溶液鉴别
c.实验室制备E时,加入浓盐酸做催化剂
d.B能被酸性KMnO4溶液氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照下列要求填空
(1)某烷烃的分子量为 72,跟氯气反应生成的一氯代物只有一种,该烷烃的结构简式为_______,名称为________________。
(2)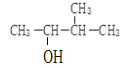 的名称
的名称![]() 系统命名法
系统命名法![]() _________。
_________。
(3)由![]() 的转化过程中,经过的反应类型依次是____________。
的转化过程中,经过的反应类型依次是____________。
(4)乙醇催化氧化生成乙醛,乙醛与环氧乙烷(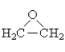 )互为_________。
)互为_________。
(5)已知葡萄糖在乳酸菌作用下可转化为乳酸(C3H6O3)。乳酸在Cu作催化剂时可被氧化成丙酮酸( ),由以上事实推知乳酸的结构简式为_________。由乳酸缩聚反应生成的高分子化合物的结构简式为________________。
),由以上事实推知乳酸的结构简式为_________。由乳酸缩聚反应生成的高分子化合物的结构简式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com