
除去Na2CO3 固体中少量NaHCO3的最佳方法是
A.加入适量盐酸 B.加入NaOH溶液
C.加热 D.配成溶液后通入CO2
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源:2014-2015学年陕西省高三上学期期中理综化学试卷(A)(解析版) 题型:选择题
下列实验“操作和现象”与“结论”对应关系正确的是
选项 | 实验操作及现象 | 实验结论 |
A | 用铂丝做某溶液的焰色反应,火焰呈黄色 | 该溶液中一定含有钠盐 |
B | 将二氧化硫通入到溴水中,溴水褪色 | 二氧化硫具有漂白性 |
C | 在滴有酚酞的Na2CO3溶液中,滴加入BaC12溶液,溶液红色逐渐褪去。 | Na2CO3溶液中存在水解平衡 |
D | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 该钾盐是K2CO3 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三上学期第二次月考化学试卷(解析版) 题型:选择题
现有如下各种说法:①在水中氢、氧原子间均以化学键相结合 ②硅晶体熔化需要克服分子间作用力 ③离子键是阳离子和阴离子的相互吸引力 ④根据电离方程式HCl===H++Cl-,判断HCl分子里存在离子键⑤有化学键断裂的变化属于化学变化。上述各种说法正确的是
A.都不正确 B.①②⑤ C.②④⑤ D.①②③
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省英文学校高一上学期12月月考化学试卷(解析版) 题型:填空题
(12分)(1)选择填空:将铝的用途与性质搭配起来(每个选项只选用一次)。
A.质轻
B.延展性好
C.易传热
D.易导电
E.氧化时放热
①太阳能热水器:__________;②飞机:__________;③焊接铁轨:____________;④电缆:__________;⑤铝箔:__________。
(2)佛山是有色金属之乡,其中铝合金材料的产量约占全国的一半。铝合金材料属于__________(填“纯净物”、“混合物”或“单质”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省英文学校高一上学期12月月考化学试卷(解析版) 题型:选择题
决定金属性强弱的是
A.1个金属原子失去电子的多少
B.1 mol金属与酸反应放出氢气的多少
C.1 mol金属失去电子的多少
D.金属原子失去电子的难易程度
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省高二上学期第三次月考化学试卷(解析版) 题型:填空题
(选做题16分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为:CrO42-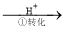 Cr2O72-
Cr2O72-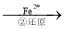 Cr3+
Cr3+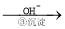 Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显 色。
(2)能说明第①步反应达平衡状态的是 。
A.Cr2O72-和CrO42-的浓度相同
B.2v (Cr2O72-)= v (CrO42-)
C.溶液的颜色不变
(3)第②步中,还原1molCr2O72-离子,需要 mol的FeSO4 7H2O。
7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在沉淀溶解平衡,请写出其沉淀溶解平衡方程式
常温下,Cr(OH)3的溶度积Ksp=[Cr3+]·[OH?]3=10?32,要使c(Cr3+)降至10?5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因是 。
⑹在阴极附近溶液pH升高的原因是(用电极反应解释) ,溶液中同时生成的沉淀还有 。
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省高二上学期第三次月考化学试卷(解析版) 题型:填空题
(5分)已知几种难溶电解质的溶度积如下表所示:
几种难溶电解质的Ksp(25℃) | |
沉淀溶解平衡 | Ksp |
| 5,0×10-13mol2·L-2 |
| 8.3×10-17mol2·L-2 |
| 6.3×10-18mol2·L-2 |
| 1.6×10-24mol2·L-2 |
| 1.3×10-36mol2·L-2 |
(1)AgBr、AgI、FeS、ZnS、CuS的溶解能力由大到小的顺序为: 。
(2)向饱和的AgI溶液中加入固体硝酸银,则[I-] (填“增大”、“减小”或“不变”),若改加AgBr固体,则[Ag+] (填“增大”、“减小”或“不变”)。
(3)在25℃时,向100mL浓度均为0.1 mol·L-1 FeCl2、ZnCl2、CuCl2的混合溶液中逐滴加入Na2S溶液,生成的沉淀的先后顺序是 (用沉淀物的化学式表示)。
(4)在25℃时,把ZnS加入蒸馏水中,一定时间后达到如下平衡:ZnS(s)  Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是
Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是
A.加入少量CuS固体 B.加入少量FeS固体
C.加入少量FeCl2固体 D.加入少量CuCl2固体
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省高二上学期第三次月考化学试卷(解析版) 题型:选择题
常温下,将0.2 mol·L-1的一元酸HA溶液和0.1 mol·L-1的NaOH溶液等体积混合后,pH大于7,若混合后溶液体积等于两溶液体积之和,则下列关系中正确的是
A.[HA]<[A-] B.[HA]一定大于0.1 mol·L-1
C.[Na+]=[HA]+[A-] D.2[OH-]=2[H+]+[HA]-[A-]
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省高二上学期第三次考试化学试卷(解析版) 题型:选择题
有4种混合溶液,分别由等体积0.1 mol·L-1的2种溶液混合而成:①CH3COONa与NaCl;②CH3COONa与NaOH;③CH3COONa与NaHSO4;④CH3COONa与NaHCO3,c(CH3COO-)排序正确的是
A.②>④>①>③ B.②>④>③>①
C.③>①>②>④ D.①>④>③>②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com