
【题目】在提纯混有少量氯化钾的硝酸钾时,第一步操作应
A.在常温下将混合物溶于水中形成浓溶液
B.在常温下将混合物溶于水中形成稀溶液
C.在较高温度下将混合物溶于水中形成浓溶液
D.在较高温度下将混合物溶于水中形成稀溶液
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】盐酸常用于清除金属表面的铜锈、铁锈。某同学欲将除锈后的盐酸中的金属元素分步沉淀,查资料获知常温下水溶液中各离子沉淀的pH范围:
离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.0 | 3.0 |
Fe2+ | 5.8 | 8.8 |
Cu2+ | 4.2 | 6.7 |
(1)若以离子浓度降至1×10-5 mol·L-1为沉淀完全,根据上表数据推算出Ksp[Fe(OH)3]=________。
(2)根据上述数据该同学设计了以下实验流程:

试剂A可能是________;试剂B的化学式是________________________;沉淀②的化学式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水中放入高锰酸钾晶体后,可以清楚地看到,溶液中紫红色范围逐渐扩大,最后整个溶液都变成紫红色,原因是( )
A.钾离子受到水分子的作用,克服了离子间的引力,逐渐向水中扩散
B.高锰酸根离子受到钾离子的作用,克服了离子间的斥力,逐渐向水中扩散
C.高锰酸根离子受到水分子的作用,克服了离子间的引力,逐渐向水中扩散
D.高锰酸钾是强氧化剂,水被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. H2(g)的燃烧热△H=-285.8 kJ/mol,则2H2O(g)=2H2(g)+O2(g) △H=+571.6 kJ/mol
B. 反应物的总能量低于生成物的总能量时,该反应为放热反应
C. 由石墨比金刚石稳定可知:c(金刚石,s)=c(石墨,s) △H<0
D. 已知:298K时,N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.0 kJ/mol。在相同温度下,向密闭容器中通入0.5 mol N2和1.5mol H2,达到平衡时放出46.0 kJ的热量
2NH3(g) △H=-92.0 kJ/mol。在相同温度下,向密闭容器中通入0.5 mol N2和1.5mol H2,达到平衡时放出46.0 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的有
①化学反应除了生成新物质外,还伴随着能量的变化
②放热反应不需要加热就能发生
③需要加热才能发生的反应都是吸热反应
④化学反应放热还是吸热。决定于生成物具有的总能量和反应物具有的总能量的大小
⑤热化学方程式应注明反应时的温度与压强,如没注明则表示常温常压时的反应
⑥等量的氢气和氧气分别完全燃烧生成气态水和液态水,前者放出的热量多
⑦H2(g)+I2(g) ![]() 2HI(g) ΔH=-QkJ·mol-1表示常温常压下,在恒温密闭容器中当有1mol H2和1mol I2(g)反应生成2 mol HI时放出QkJ的热量
2HI(g) ΔH=-QkJ·mol-1表示常温常压下,在恒温密闭容器中当有1mol H2和1mol I2(g)反应生成2 mol HI时放出QkJ的热量
⑧同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照条件下和点燃条件下的ΔH相同
A. 2项 B. 3项 C. 4项 D. 5项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Al和不同的铜盐溶液间的反应为实验对象,探索Al与不同铜盐溶液反应的多样性。
实验 | 向试管中加入2ml溶液 | 实验现象 |
| 实验Ⅰ:0.5mol/LCuCl2溶液 | 15s:大量气泡且有红色物质析出 60s:反应进一步加快且反应剧烈放热,液体几乎沸腾 120s:铝片反应完,试管中析出大量蓬松的红色物质 |
实验Ⅱ:0.5mol/LCuSO4溶液 | 15s 无明显现象 60s:铝片表面有极少气泡 120s:有少量气泡溢出,铝片边缘有很少红色物质生成 |
(1)对实验Ⅰ进行研究②④
①实验Ⅰ中生成红色物质的离子方程式为:____________________________
经检验实验Ⅰ中产生的气体为氢气,用离子方程式解释溶液中存在H+的原因:_____________________
③请写出60s后反应进一步加快可能的原因(写出两条)_____________________________
(2)对实验Ⅱ进行研究
实验Ⅱ反应明显比实验Ⅰ缓慢,说明Al与不同的铜盐溶液反应呈现多样性,其原因可能有:
假设一:SO42-对Al与Cu2+的置换反应存在一定的抑制作用。
假设二:________________________
(3)为进一步研究上述假设,设计如下实验:
实验 | 向试管中加入2mL溶液 | 实验现象 |
| 实验Ⅲ:0.5mol/LCuCl2溶液+1g Na2SO4固体 | 加入 Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 |
实验Ⅳ:0.5mol/L CuCl2溶液+5g Na2SO4固体 | 加入Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 | |
实验Ⅴ:0.5mol/LCuSO4溶液+0.02mol NaCl固体 | 未加入 NaCl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 | |
实验Ⅵ:0.5mol/LCuSO4溶液+_________ NH4Cl固体 | 未加入 NH4Cl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 |
_____________________________________
其中,实验Ⅰ与实验Ⅲ、Ⅳ做对比,结论为:______________________________________
其中,实验Ⅱ与实验Ⅴ、Ⅵ做对比,结论为:______________________________________
(4)请设计实验证明Cl-对Al与H+的反应同样起到相似的作用:_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷,它受热易分解,为了验证其气态产物,某同学设计了如下实验装置:

(1)若实验中,观察到B、E中的溶液均变浑浊,则D中的现象是_______________________________;
说明其气态产物是________、________;为验证另一种气态产物,应在A、B之间增加的装置为____________。
(2)为了使实验更安全、更严密,你认为该实验设计需要如何改进?
①________________________________;
②_________________________________。
(3)固体产物中铁元素不可能以+3价形式存在,理由是__________________________。
现设计实验,探究固体产物中铁元素的存在形式。
①提出合理假设。
假设1:____________________________;
假设2:____________________________;
假设3:____________________________。
②某学生设计实验探究上述假设,除3%H2O2、蒸馏水外,还需要下列试剂中的____________________________________。
限选试剂:浓硫酸、1.0 mol·L-1HNO3、1.0 mol·L-1盐酸、1.0 mol·L-1NaOH溶液、0.1 mol·L-1KI溶液、0.1 mol·L-1CuSO4溶液、20%KSCN溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为研究生铁(含碳)与浓硫酸的反应情况及产物性质,设计如下实验。请回答下列问题:
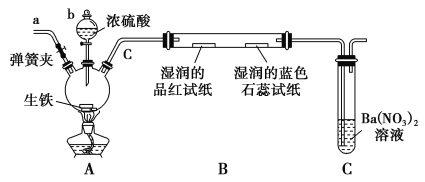
(1)按上图所示装置进行实验(夹持装置及尾气处理装置未画出)。仪器b的名称为________;实验过程中,装置B中观察的现象是______________________。
(2)装置C中有白色沉淀生成,该反应化学方程式为_______________________。
(3)装置A中还会产生CO2气体,请写出产生CO2的化学方程式:_______________________。
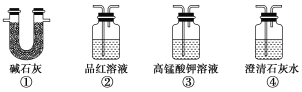
(4)为了验证装置A中产生的气体中含有CO2,应先从下列①~④中选出必要的装置连接A装置中c处管口,从左到右的顺序为________(填序号);然后再进行的操作是从a处多次鼓入N2,其目的是___________________________。
(5)某同学通过验证实验后期装置A中产生的气体中还含有H2,反应的离子方程式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是反应![]()
![]()
![]() 在不同条件下进行时
在不同条件下进行时![]() 的转化率:
的转化率:
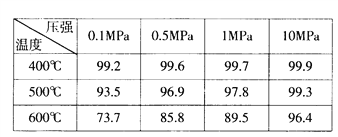
从上表中你得到的启示?
(1)关于可逆反应的限度:______________。
(2)提高该化学反应限度的途径有:________________。
(3)要实现![]() 的转化率为93.5%需控制的反应条件是___________________。
的转化率为93.5%需控制的反应条件是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com