
| A. | 能导电的有①②⑤⑥ | |
| B. | 属于电解质的有⑤⑦⑧ | |
| C. | 属于强电解质的有⑤⑥⑧ | |
| D. | 既不属于电解质又不属于非电解质的有①②③④ |
分析 A.物质能导电必须存在能自由移动的离子或电子;
B.电解质是指在水溶液里或熔化状态下能导电的化合;
C.强电解质是在水溶液里完全电离的电解质;
D.从电解质、非电解质的概念分析.
解答 解:A.物质能导电必须存在能自由移动的离子或电子,①石墨 ②铜丝因为有自由移动电子而导电,⑥稀H2SO4 ⑦水中因为有自由移动离子而导电,而⑤NaCl固体中离子不能自由移动,故不能导电,故A错误;
B.电解质是指在水溶液里或熔化状态下能导电的化合物,⑤NaCl固体 ⑦水在水溶液里能导电是电解质,⑧硫酸钡在熔融状态下能导电,故为电解质,故B正确;
C.强电解质是在水溶液里完全电离的电解质,⑤食盐 ⑧硫酸钡 完全电离,是强电解质,⑥稀H2SO4 是混合物,既不是电解质也不是非电解质,故C错误;
D.①②③都是单质,既不属于电解质又不属于非电解质,而④二氧化碳为非电解质,故D错误;
故选B.
点评 本题考查了电解质和非电解质等基本概念,并对电解质的导电情况进行了判别,属于易错题目,要注意积累知识和应用知识.


科目:高中化学 来源: 题型:实验题
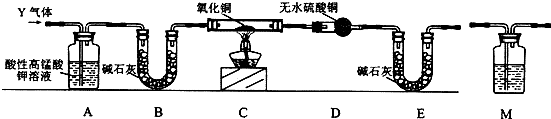
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
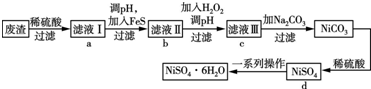
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
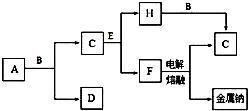 中学化学中常见的几种物质存在如图所示的转化关系,其中,A是一种黑色粉末状固体,C是一种黄绿色气体.实验室中常用E溶液吸收多余的C.(图中部分产物和反应条件已略去).
中学化学中常见的几种物质存在如图所示的转化关系,其中,A是一种黑色粉末状固体,C是一种黄绿色气体.实验室中常用E溶液吸收多余的C.(图中部分产物和反应条件已略去).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学小组同学发现84消毒液(主要成分为NaClO)与洁厕剂(主要成分为盐酸)室温下混合有Cl2生成,于是尝试在实验室利用该反应原理制取Cl2.
某化学小组同学发现84消毒液(主要成分为NaClO)与洁厕剂(主要成分为盐酸)室温下混合有Cl2生成,于是尝试在实验室利用该反应原理制取Cl2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com