
用下图装置模拟人工肾脏的工作原理,电解生成的Cl2将尿素[CO(NH2)2]氧化成N2排出,则下列说法错误的是
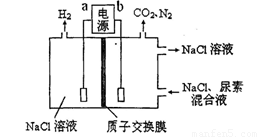
A.电源的正极为b
B.尿素被氧化的化学方程式为CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl
C.电解结束后,阴极室溶液与电解前相比pH增大
D.阳极收集到气体4.48 L(标准状况)时,被氧化的尿素为6.0 g
C
【解析】
试题分析:由于在b电极电解产生Cl2,说明在b电极发生了反应:2Cl—2e-= Cl2↑.所以b电极区为阳极区,b为正极,在b区尿素[CO(NH2)2]氧化成N2的化学反应方程式为:CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl。由方程式可看出每转移电子6mol,产生气体2mol,被氧化的尿素60g.现在在阳极收集到气体4.48 L(标准状况)时,即0.2mol,所以被氧化的尿素为6.0 g。a电极区为阴极区,a电极为负极。电极反应2H2O+2e-=H2↑+2OH-。每转移6mol的电子,就会产生3mol的氢气和6mol的OH-,这时就有6mol的H+通过离子交换膜从阳极区到阴极区,因此溶液的PH不会发生变化。说法错误的是C。
考点:考查电解的化学反应原理的知识。


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源:2013届山东省潍坊市高三3月第一次模拟考试化学试卷(带解析) 题型:填空题
甲醇(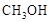 )是重要的能源物质,研究甲醇具有重要意义。
)是重要的能源物质,研究甲醇具有重要意义。
(1)利用工业废气中的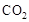 可制取甲醇,其反应为:
可制取甲醇,其反应为: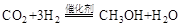
常温常压下已知下列反应的能量变化如图所示:
写出由二氧化碳和氢气制备甲醇的热化学方程式:
。
(2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了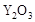 的
的 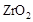 晶体,在高温下它能传导
晶体,在高温下它能传导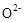 离子。电池工作时正极反应为 。
离子。电池工作时正极反应为 。
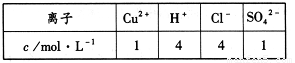
若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液。
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的物质的量为 mol。
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将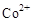 氧化成
氧化成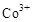 ,然后以
,然后以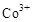 做氧化剂把水中的甲醇氧化成
做氧化剂把水中的甲醇氧化成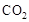 而净化。实验室用下图装置模拟上述过程:
而净化。实验室用下图装置模拟上述过程:
①写出阳极电极反应式 ;
②除去甲醇的离子反应为: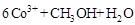
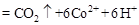 ,该过程中被氧化的元素是 ,当产生标准状况下2.24L
,该过程中被氧化的元素是 ,当产生标准状况下2.24L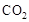 时,共转移电子 mol。
时,共转移电子 mol。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年内蒙古鄂尔多斯市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂。钙在加热时能与氮气、氢气反应。氢化钙遇水立即反应生成氢氧化钙和氢气。氢化钙通常用氢气与金属钙加热制取,下图是模拟制取装置。

(1)下列关于氢化钙的叙述正确的是 (选填序号)。
a.氢化钙中阴离子的半径小于Li+的半径
b.氢化钙的式量小于溴化氢,因此前者的熔点小于后者
c.氢化钙也能与盐酸反应生成氢气
d.氢气常用作还原剂,只具有还原性
(2)上图A装置中制备氢气所用的酸溶液最好选用 (选填序号)。
a.稀盐酸 b.稀硫酸 c.稀硝酸 d.均可以
(3)装置D中竖直导管的作用是 。
(4)为了确认进入装置C的氢气已经干燥,可在B、C之间再接一装置,该装置中加入的试剂是 。加热C装置前要对H2验纯,验纯的操作是 。
(5)甲同学认为只要装置合理、操作规范就可以排除生成 (选填序号)。
a.Ca3N2 b.CaO c.Ca(OH)2
(6)乙同学用下图装置测定制得的氢化钙的纯度。他称取48g样品,与足量的水反应,恒温时,注射器量出产生的气体为48.16 L(已换算为标准状况)。假设钙只与氢气发生了反应,请根据乙同学的实验数据计算氢化钙的纯度(写出计算过程) 。

查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省开封市高三第二次质量检测理综化学试卷(解析版) 题型:简答题
甲醇是重要的化工原料,在日常生活中有着广泛的应用。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①在以上制备甲醇的两个反应中:反应Ⅰ优于反应Ⅱ,原因为_________________。
②对于反应Ⅰ,下图甲表示能量的变化;图乙表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时闻峦化。

在“图甲”中,曲线__________(填:“a”或“b”)表示使用了催化剂;该反应属于________(填:“吸热”、“放热”)反应。在图乙中从反应开始到建立平衡,用H2浓度变化表示的反应速率为_____________;该温度下CO(g)+2H2(g) CH3OH(g)的化学平衡常数为__________.
CH3OH(g)的化学平衡常数为__________.
③对于反应Ⅱ,在一定温度时,将lmol CO2年和3mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为a,则容器内的平衡压强与起始压强之比为__________;若容器容积不变,下列措施可增加甲醇产率的是____________。
a.升高温度
b.增加CO2的量
c.充入He,使体系总压强增大
d.按原比例再充入CO2和H2
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种 污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程。

①阳极电极反应式为____________。
②除去甲醇的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省潍坊市高三3月第一次模拟考试化学试卷(解析版) 题型:填空题
甲醇(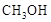 )是重要的能源物质,研究甲醇具有重要意义。
)是重要的能源物质,研究甲醇具有重要意义。
(1)利用工业废气中的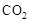 可制取甲醇,其反应为:
可制取甲醇,其反应为: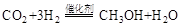
常温常压下已知下列反应的能量变化如图所示:

写出由二氧化碳和氢气制备甲醇的热化学方程式:
。
(2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了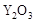 的
的 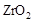 晶体,在高温下它能传导
晶体,在高温下它能传导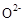 离子。电池工作时正极反应为 。
离子。电池工作时正极反应为 。
若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液。
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的物质的量为 mol。
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将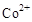 氧化成
氧化成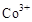 ,然后以
,然后以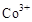 做氧化剂把水中的甲醇氧化成
做氧化剂把水中的甲醇氧化成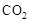 而净化。实验室用下图装置模拟上述过程:
而净化。实验室用下图装置模拟上述过程:
①写出阳极电极反应式 ;
②除去甲醇的离子反应为: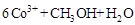
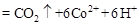 ,该过程中被氧化的元素是 ,当产生标准状况下2.24L
,该过程中被氧化的元素是 ,当产生标准状况下2.24L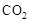 时,共转移电子 mol。
时,共转移电子 mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com