
【题目】如图表示在密闭容器中反应:2SO2+O22SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是;b c过程中改变的条件可能是; 若增大压强时,反应速度变化情况画在c~d处. 
【答案】升温;减小生成物浓度
【解析】解:根据图可知,在a时刻,正逆反应速率都增大,且逆反应速率大于正反应速率,即平衡逆向移动,因为反应的△H<0,根据影响化学反应速率和化学平衡的条件可知,a~b过程中改变的条件可能是升温;在b时刻,正反应速率不变,逆反应速率减小,且正反应速率大于逆反应速率,即平衡正向移动,根据影响化学反应速率和化学平衡的条件可知,b~c过程中改变的条件可能是减小生成物C的浓度;在b~c过程后,若增大压强,正逆反应速率都会增大,由于该反应为体积缩小的反应,所以平衡正向移动,根据压强对化学反应速率的影响可画出相关的图为: 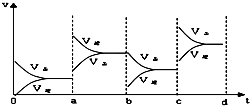 ;
;
故答案为:升温;减小生成物的浓度;  .
.
根据影响化学反应速率和化学平衡的条件可作判断;根据压强对化学反应速率的影响可画出相关的图.


科目:高中化学 来源: 题型:
【题目】在一定温度下,10L密闭容器中加入5molSO2、4.5molO2 , 经10min后反应达平衡时,有3molSO2发生了反应.试回答下列问题:
(1)O2的转化率为多少?
(2)用SO2表示该反应的反应速率为多少?
(3)平衡时容器内气体压强与反应前的压强之比为多少?(最简整数比)
(4)平衡时体系中SO3的百分含量(体积分数)为多少?
(5)平衡常数K为多少?
(6)若向平衡混合物的容器中通人少量氦气后,化学平衡如何移动?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法,不正确的是( )
A.双键、三键中都含有π键
B.成键原子间原子轨道重叠愈多,共价键愈牢固
C.因每个原子未成对的电子数是一定的,故与其配对的原子个数也一定
D.所有原子轨道在空间中都有自己的方向性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关σ键和π键的说法正确的是( )
A.单键既有σ键也有π键
B.所有的π键都容易打开
C.σ键可沿键轴自由旋转而不影响键的强度
D.π键比σ键重叠程度大,形成的共价键强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是( )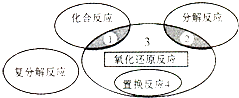
A.4Fe(0H)2+O2+2H2O═4Fe(OH)3
B.2H2O2 ![]() 2H2O+O2↑
2H2O+O2↑
C.3CO+Fe2O3 ![]() 3CO2+2Fe
3CO2+2Fe
D.Zn+H2SO4═ZnSO4+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列条件一定能使反应速率加快的是
①增加反应物的物质的量②升高温度③缩小反应容器的体积④加入生成物⑤加入MnO2
A. 全部B. ①②⑤C. ②D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是( )
A.向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3﹣=3Fe3++2H2O+NO↑
B.铜与浓硝酸反应:Cu+NO3﹣+4H+=Cu2++NO↑+2H2O
C.氯化铵溶液和浓氢氧化钠溶液混合后加热:NH4++OH﹣ ![]() NH3H2O
NH3H2O
D.碳酸氢铵溶液与足量氢氧化钠溶液混合后加热:NH4++OH﹣ ![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com