
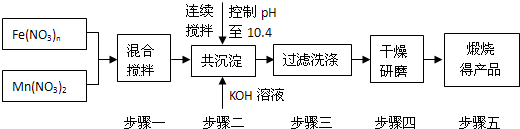
随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下:
(1)原料Fe(NO3)n中n=______,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为______。
(2)步骤二中“连续搅拌”的目的是_________________________________________;
步骤三中洗涤干净的标准是________________________________________。
(3)利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4 MnFe2O4-x+
O2↑MnFe2O4-x+ xH2O→MnFe2O4 + xH2↑,
请认真分析上述两个反应并回答下列问题:
①若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分率为_______。
②该化学循环制氢的优点有(答两点即可)
_____________________________________________________________________。
③该热化学循环法制氢尚有不足之处,进一步改进的研究方向是_________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| >1000K |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| >1000K |
| x |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 开始沉淀 | 完全沉淀 | |
| Fe3+ | 2.7 | 4.2 |
| Mn2+ | 8.3 | 10.4 |
| 1000k |
| x |
| 2 |
| 2 |
| x |
| 2 |
| x |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年四川省高考前热身试题(理综)化学部分 题型:填空题
(15分)
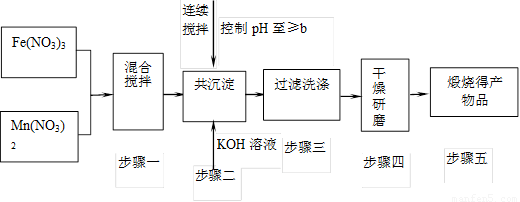
随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢。
Ⅰ.MnFe2O4的制备:

 已知Fe3+、Mn2+沉淀的pH为下表所示。
已知Fe3+、Mn2+沉淀的pH为下表所示。
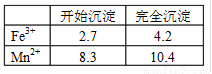
(1)此工艺中理论上投入原料Fe(NO3)3和Mn(NO3)2
 的物质的量之比应为
。
的物质的量之比应为
。
(2)步骤二中b的值为 。
 (3)步骤三中洗涤干净的标准是
。
(3)步骤三中洗涤干净的标准是
。
Ⅱ.用MnFe2O4热化学循环制氢:
 MnFe2O4(s)→MnFe2O(4-x)(s) +
MnFe2O4(s)→MnFe2O(4-x)(s) + 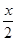 O2(g);△H1
O2(g);△H1
MnFe2O(4-x)(s)+ xH2O →MnFe2O4(s) + xH2(g);△H2
 请回答下列问题:
请回答下列问题:
(4) 若MnFe2O(4-x)中x=0.8,则MnFe2O(4-x)中Fe2+在全部铁元素中的质量分数为 。
 (5)该热化学循环制氢的优点有
(填序号)。
(5)该热化学循环制氢的优点有
(填序号)。
A.过程简单、无污染 B.物料可循环使用  C.氧气和氢气在不同步骤生成,安全且易分离
C.氧气和氢气在不同步骤生成,安全且易分离
(6)已知 2H2(g)+O2(g)= 2H2O(g);△H3
 则:△H3与△H1、△H2的关系为△H3= 。
则:△H3与△H1、△H2的关系为△H3= 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年吉林省高考复习质量监测(理综)化学部分 题型:填空题
(15分)
随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下:

(1)原来Fe(NO3)n中n= ,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为 。
(2)步骤二中“连续搅拦”的目的是 ;
步骤三中洗涤干净的标准是 。
(3)利用MnFe2O4热化学循环制氢的反应可表示为:
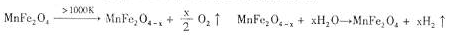
请认真分析上述两个反应并回答下列问题:
①项MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分率为 。
②热化学循环制氢的优点有(答两点即可) 。
③该热化学循环法制氢尚有不足之处,进一步改进的研究方向是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com