

 ×100%=90%,
×100%=90%, =
= =0.05mol,含有硫的物质的量为:0.1mol,全部被氧化为SO3气体,再将产生的SO3气体全部与水化合生成硫酸溶液时,放出13.03kJ热量,则1molSO3气体全部与水化合生成硫酸溶液时,放出130.3kJ热量,所以热化学方程式为:SO3(g)+H2O(l)═H2SO4(aq)△H=-130.3KJ/mol;
=0.05mol,含有硫的物质的量为:0.1mol,全部被氧化为SO3气体,再将产生的SO3气体全部与水化合生成硫酸溶液时,放出13.03kJ热量,则1molSO3气体全部与水化合生成硫酸溶液时,放出130.3kJ热量,所以热化学方程式为:SO3(g)+H2O(l)═H2SO4(aq)△H=-130.3KJ/mol;

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
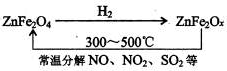
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
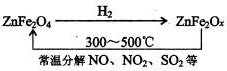
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com