
| A. | v(A)=0.005mol•L-1•s-1 | B. | v(C)=0.02mol•L-1•s-1 | ||
| C. | v(B)=$\frac{v(A)}{3}$ | D. | v(A)=0.01mol•L-1•s-1 |
分析 先根据v=$\frac{\frac{△c}{V}}{△t}$计算出该时间段内用C表示的平均反应速率,然后根据化学反应速率与化学计量数成正比对各选项进行判断.
解答 解:0.5min内C的物质的量增加了0.6mol,则用C表示的平均反应速率为:v(C)=$\frac{\frac{0.6mol}{2L}}{0.5min}$=0.6mol•L-1•min-1=0.01mol•L-1•s-1,
A.v(A)=$\frac{1}{2}$v(C)=0.005mol•L-1•s-1,故A正确;
B.根据计算可知v(C)=0.01mol•L-1•s-1,故B错误;
C.v(B)=3v(A),故C错误;
D.根据A可知,v(A)=$\frac{1}{2}$v(C)=0.005mol•L-1•s-1,故D错误;
故选A.
点评 本题考查了化学反应速率与化学计量数的关系,题目难度不大,明确化学反应速率与化学计量数成正比为解答关键,注意掌握化学反应速率的概念及表达式,试题培养了学生的化学计算能力.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| 物质 | 试剂 | 分离方法 | |
| ① | 硝酸钾(氯化钠) | 蒸馏水 | 降温结晶 |
| ② | Na2SO4(NH4Cl) | 加入升华 | |
| ③ | 乙醇(水) | 金属钠 | 蒸馏 |
| ④ | NaCl溶液(Na2S) | AgCl | 过滤 |
| A. | ①③ | B. | ①④ | C. | 只有② | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中可能含有非极性键 | B. | 分子晶体中的分子内不含有离子键 | ||
| C. | 原子晶体中可能含有非极性键 | D. | 分子晶体中的分子内一定有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 邻甲基苯酚可被KMnO4( H +,aq ) 氧化为邻羟基苯甲酸 | |
| B. | 葡萄糖能被新制Cu( OH )2氧化,但不能使溴水褪色 | |
| C. | 苯及其同系物都不能使溴水褪色 | |
| D. | 羧酸不具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油分馏可得到汽油、煤油和柴油等产品 | |
| B. | 石油的催化重整可得到芳香烃 | |
| C. | 石油裂解主要是为了得到更多的汽油 | |
| D. | 煤、石油、天然气是不可再生的一次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
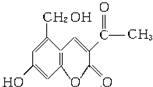
 .
.

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Al3+、Br-、SO42- | B. | Na+、K+、OH-、SiO32- | ||
| C. | Ca2+、K+、Br-、Cl- | D. | Li+、H+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积.该小组设计的简单实验装置如图所示:该实验的主要操作步骤如下:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积.该小组设计的简单实验装置如图所示:该实验的主要操作步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com