
【题目】现有下列九种物质:①H2 ②铝 ③CuO ④CO2⑤H2SO4 ⑥Ba(OH)2固体⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)上述状态下可导电的是;
属于电解质的是;
属于非电解质的是 .
(2)上述九种物质中有两种物质之间可发生离子反应:H++OH﹣═H2O,该离子反应对应的化学方程式为 .
(3)⑨在水中的电离方程式为 , 34.2g ⑨溶于水配成250mL溶液,SO42﹣的物质的量浓度为 .
【答案】
(1)②⑦⑧⑨;③⑤⑥⑨;④
(2)Ba(OH)2+2HNO3=Ba(NO3)2+2H2O
(3)Al2(SO4)3=2Al3++3SO42﹣;1.2mol/L
【解析】解:(1)②铝中含有自由电子,⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3都存在自由移动的离子,所以能够导电;
③CuO ⑤H2SO4 ⑥Ba(OH)2固体⑨熔融Al2(SO4)3都是化合物,在水溶液或者熔融状态下能够导电,属于电解质;
④CO2自身不能电离出自由移动离子,不能导电属于非电解质;
所以答案是:②⑦⑧⑨;③⑤⑥⑨;④;(2)硝酸与氢氧化钡反应的实质是氢离子与氢氧根离子反应生成水,可以用离子方程式H++OH﹣═H2O表示,对应反应为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;
所以答案是:Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;(3)硫酸铝在水中电离产生铝离子和硫酸根离子,电离方程式为:Al2(SO4)3=2Al3++3SO42﹣;
硫酸铝的物质的量= ![]() =0.1mol,硫酸根离子的物质的量=0.1mol×3=0.3mol,硫酸根离子的物质的量浓度=
=0.1mol,硫酸根离子的物质的量=0.1mol×3=0.3mol,硫酸根离子的物质的量浓度= ![]() =1.2mol/L;
=1.2mol/L;
所以答案是:Al2(SO4)3=2Al3++3SO42﹣;1.2mol/L.


科目:高中化学 来源: 题型:
【题目】一定条件下,在容积固定的某密闭容器中发生反应N2+3H2![]() 2NH3。在10s内N2的浓度由5 mol·L-1降至4 mol·L-1,下列说法正确的是( )
2NH3。在10s内N2的浓度由5 mol·L-1降至4 mol·L-1,下列说法正确的是( )
A. 用NH3表示的化学反应速率为0.1 mol·L-1·s-1
B. 使用合适的催化剂,可以加快该反应的速率
C. 增加H2的浓度或降低温度都会加快该反应速率
D. 反应足够长时间,N2、H2中至少有一种物质浓度降为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课外实验小组为了探究锌与盐酸反应过程中的化学反应速率的变化,在100mL稀盐酸中加入足量的锌粉,标准状况下用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5min,下同)反应速率最大,可能的原因 .
(2)哪一段时段的反应速率最小 , 原因是 .
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率为 .
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
A.蒸馏水
B.CH3COONa固体
C.Na2CO3溶液
D.CuSO4溶液你认为可行的是(填编号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯: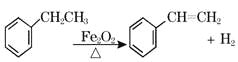 ,下列说法正确的是( )
,下列说法正确的是( )
A. 该反应的类型为消去反应
B. 乙苯的同分异构体共有三种
C. 可用Br2/CCl4鉴别乙苯和苯乙烯
D. 乙苯和苯乙烯分子内共平面的碳原子数均为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2既是温室气体,也是重要的化工原料。以CO2为原料可合成多种物质。
(1)利用CO2和CH4重整可制合成气(主要成分CO、H2),重整过程中部分反应的热化学方程式为:
①CH4(g) = C(s) + 2H2(g) △H = +75.0 kJ·mol1
②CO2(g) + H2(g) = CO(g) + H2O(g) △H = +41.0 kJ·mol1
③CO(g) + H2(g) = C(s) + H2O(g) △H = -131.0 kJ·mol1
反应CO2(g) + CH4(g) = 2CO(g) + 2H2(g)的△H= ____。
(2)在一定温度下,向2L固定容积的密闭容器中通入2 mol CO2和6 mol H2发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。测得CO2和CH3OH(g)浓度随时间变化如下图所示。
CH3OH(g)+H2O(g) △H<0。测得CO2和CH3OH(g)浓度随时间变化如下图所示。
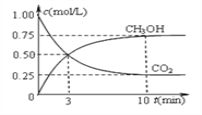
①前10 min内的平均反应速率υ(H2)=____ mol∕(L·min)。
②能说明该反应已达平衡状态的是____。
A.c(CO2):c(H2):c(CH3OH):c(H2O)=1:3:1:1
B.混合气体的平均摩尔质量保持不变
C.CH3OH的体积分数在混合气体中保持不变
D.混合气体的密度不随时间变化
③下列措施能使n(CH3OH) ∕n(CO2) 增大的是____。
A.升高温度 B.恒温恒容充入He(g)
C.使用高效催化剂 D.恒温恒容下,再充入1mol CO2、3mol H2
④该温度下的平衡常数K=____(L∕mol)2。
(3)用100mL 0.25 mol∕L Na2CO3溶液吸收标准状况下336mL的CO2气体(溶液体积变化忽略不计),所得溶液中:c(HCO3)+c(CO32)+c(H2CO3)=____ mol∕L(填数字)。
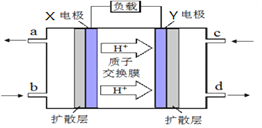
(4)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图所示。

① b电极的名称是____。
② 请写出电解时生成乙烯的电极反应式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是 ( )
A. H2(g)的燃烧热为571.6 kJ·mol-1
B. 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C. ![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)===
Ba(OH)2(aq)===![]() BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D. 3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列在理论上可设计成原电池的化学反应是( )
A. C(s)+H2O(g)=CO(g)+H2 (g)
B. Ba(OH)28H2O(s)+2NH4C1(s)=BaCl2(aq)+2NH3H2O(l)+8H2O(l)
C. C(s)+CO2(g)=2CO(g)
D. CH4(g)+2O2(g)→CO2(g)+2H2O(l)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照下列图表和有关要求回答问题:
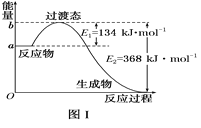
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是_________(填“增大”“减小”或“不变”,下同),ΔH的变化是_________。请写出NO2和CO反应的热化学方程式:___________________________。
(2) 甲醇既是重要的化工原料,又可作为燃料。
Ⅰ.利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇。发生的主要反应如下:
①CO(g)+2H2(g)=CH3OH(g) ΔH1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)=CO(g)+H2O(g) ΔH3
已知反应①中相关的化学键键能数据如下:
化学键 | H-H | C-O |
| H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算ΔH1=_________kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=______kJ·mol-1。
Ⅱ.甲醇质子交换膜燃料电池的工作原理如上图所示,写出X电极的电极反应式_______________。
(3) 下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式: __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列涉及有机物的说法中正确的是
A.乙烯、氯乙烯都是不饱和烃,均可用于合成有机高分子材料
B.煤的干馏可得到煤焦油,煤焦油蒸馏可得到苯、甲苯等芳香烃
C.在加热条件下,加入适量生石灰以除去乙酸乙酯中含有的乙醇杂质
D.淀粉和纤维素的水解产物都是葡萄糖,二者互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com