
| ��ѧʽ | CH3COOH | H2CO3 | HClO |
| ����ƽ�ⳣ�� | 1.8��10-5 | K1=4.3��10-7 K2=5.6��10-11 |
3.0��10-8 |
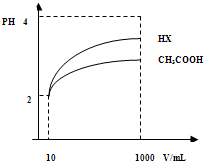


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2012?��ׯ��ģ��������ˮ��Һ�е���Ϊ����ѧ��ѧ����Ҫ���ݣ���֪�������ʵĵ��볣��ֵ��25�棩��
��2012?��ׯ��ģ��������ˮ��Һ�е���Ϊ����ѧ��ѧ����Ҫ���ݣ���֪�������ʵĵ��볣��ֵ��25�棩��
| ||
| ||
| 10-9 |
| x-10-2 |
| 10-9 |
| x-10-2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| a |
| 200b |
| a |
| 200b |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| a |
| 200 |
| a |
| 200 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
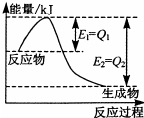 ���û�ѧ��Ӧԭ���о��������ȵȵ��ʼ��仯����ķ�Ӧ����Ҫ�����壮
���û�ѧ��Ӧԭ���о��������ȵȵ��ʼ��仯����ķ�Ӧ����Ҫ�����壮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�꽭��ʡ�����и�����ѧ����ĩ��ѧ�������ۻ�ѧ�Ծ��������棩 ���ͣ������
����ʹ�������Դ����չ����̼����������Ϊ��ѧ���о�����Ҫ���⡣�������״������ʵ����ȼ�ϣ�������ȼ�ϵ�ء�
��1������ˮ����ת������H2����Ҫת����Ӧ���£�
CH4(g) + H2O(g) CO(g) + 3H2(g)? ��H=+206��2 kJ��mol��1
CO(g) + 3H2(g)? ��H=+206��2 kJ��mol��1
CH4(g) + 2H2O(g) CO2(g) + 4H2(g)? ��H=+165��0 kJ��mol��1
CO2(g) + 4H2(g)? ��H=+165��0 kJ��mol��1
������Ӧ����ԭ�����е�CO��ʹ�ϳɰ��Ĵ����ж��������ȥ����ҵ�ϳ����ô���������CO��ˮ������Ӧ�����׳�ȥ��CO2��ͬʱ���Ƶõ�����������ķ������˷�Ӧ��Ϊһ����̼�任��Ӧ���÷�Ӧ���Ȼ�ѧ����ʽ��??????? ��
��2�������״���ԭ��CO��H2��Դ�ڣ�CH4(g) + H2O(g)  CO(g) + 3H2(g)? ��H>0
CO(g) + 3H2(g)? ��H>0
��һ��������CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼa����A��B��C���㴦��Ӧƽ�ⳣ����KA��KB��KC���Ĵ�С��ϵΪ___________��(����<������>������=�� )��

��100��ʱ����1 mol CH4��2 mol H2Oͨ���ݻ�Ϊ1 L�Ķ����ܷ������У�������Ӧ����˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����__________
a�������������ܶȺ㶨??
b����λʱ��������0��1 mol CH4ͬʱ����0��3 mol H2
c��������ѹǿ�㶨??????
d��3v��(CH4) = v��(H2)
��3��25��ʱ����20mL0��1mol/L������м���VmL0��1mol/LNaOH��Һ����û����Һ��pH�仯������ͼ��ʾ������˵����ȷ����_____��

A��pH��3��HF��Һ��pH��11��NaF��Һ���� ��ˮ�������c(H+)���
B������ʱpH��6����ʱ��Һ����c(F��)��c(Na+)��9��9��10-7mol/L
C������ʱ����Һ�е�c(F��)��c(Na+)
D������ʱV��20mL����ʱ��Һ��c(Na+)��0��1mol/L
��4������������һֱ��Ϊ���ĺ�������ڡ�1971��������ѧ���÷���ͨ��ϸ��ĩʱ���HFO����ṹʽΪH��O��F��HFO��ˮ��Ӧ�õ�HF�ͻ�����A���÷�Ӧ�Ļ�ѧ����ʽΪ????????????????????? ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com