
| A. | 10℃时,粉末状锌与3 mol/L硫酸溶液反应 | |
| B. | 50℃时,粉末状锌与3 mol/L硫酸溶液反应 | |
| C. | 10℃时,块状锌与3 mol/L硫酸溶液反应 | |
| D. | 50℃时,块状锌与3 mol/L硫酸溶液反应 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
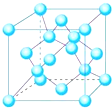 有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题:
有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题: ,YQ3中心原子的杂化类型为sp2杂化,除X外,其余元素的第一电离能由小到大顺序为B<C<O<N<F(元素符号回答).
,YQ3中心原子的杂化类型为sp2杂化,除X外,其余元素的第一电离能由小到大顺序为B<C<O<N<F(元素符号回答). ,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.
,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;该微粒的表示符号为O2-.
;该微粒的表示符号为O2-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率加快,逆反应速率减慢,平衡向正反应方向移动 | |
| B. | 逆反应速率加快,正反应速率减慢,平衡向逆反应方向移动 | |
| C. | 正、逆反应速率都不变,平衡向逆反应方向移动 | |
| D. | 正、逆反应速率都减慢,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4溶液 | B. | HCl溶液 | C. | NaOH溶液 | D. | NaNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉久置于空气中会增加漂白效果 | |
| B. | 以海水为原料能制取Na、HCl、Mg、Br2等物质 | |
| C. | 蓝铜矿[Cu3(OH)2(CO3)2]也可表示为3CuO•2CO2•2H2O | |
| D. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 断开化学键的过程会放出能量 | |
| B. | 氧化反应均为吸热反应 | |
| C. | 加热才能发生的反应一定是吸热反应 | |
| D. | 放热反应中,反应物的总能量大于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
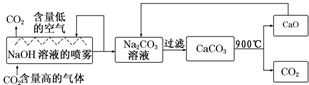
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
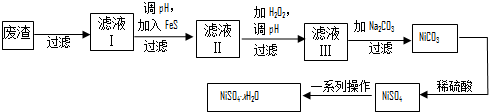
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com