
| A、原子半径:F>Cl>Br>I |
| B、单质的氧化性:I2>Br2>Cl2>F2 |
| C、熔、沸点:F2>Cl2>Br2>I2 |
| D、热稳定性:HF>HCl>HBr>HI |


科目:高中化学 来源: 题型:
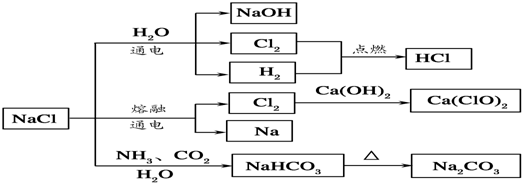
| A、25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| B、石灰乳和Cl2反应可制得漂白粉,其主要成分是次氯酸钙 |
| C、常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 |
| D、如图所示转化反应不都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、吸引电子能力的大小顺序一定为Z>Y>W |
| B、原子半径的大小顺序一定为X>Y>Z>W |
| C、Y、Z形成的分子的空间构型一定是正四面体 |
| D、原子核外未成对电子数可能是Z>Y>X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-→NH3↑+H2O |
| B、在NH4Al(SO4)2(一种复盐)的溶液中加入Ba(OH)2溶液至沉淀的质量达到最大时:Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+AlO2-+2H2O |
| C、当Ba(OH)2和NaHSO4 混合恰好呈中性:Ba2++2OH-+2H++SO42-→BaSO4↓+2H2O |
| D、向烧碱溶液中通入CO2,当n(NaOH):n(CO2)=3:2时:OH-+CO2→HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、每生成1mol Fe3O4,反应转移的电子总数为2mol | ||
| B、Fe2+和S2O32-都是还原剂 | ||
C、1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为
| ||
| D、x=4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
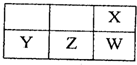 短周期元素X、Y、Z、W在周期表中的相对位置如图所示,Z的单质是常见的半导体材料.由此可知( )
短周期元素X、Y、Z、W在周期表中的相对位置如图所示,Z的单质是常见的半导体材料.由此可知( )| A、X、Z、W的简单氢化物的稳定性Z>W>X |
| B、W元素的单质在化学反应中只表现还原性 |
| C、X、Y的简单离子半径Y>X |
| D、Y、Z、W的最高价氧化物均能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、发生电化学腐蚀,铜为负极,铜极产生H2 |
| B、铜易被腐蚀,铜极上发生还原反应,吸收O2 |
| C、铁易被腐蚀,铁发生氧化反应,Fe-2e→Fe2+ |
| D、发生化学腐蚀:Fe+Cu2+→Cu+Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com