
| A. | 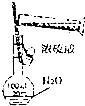 稀释浓硫酸 | B. | 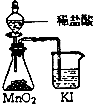 比较MnO2、CI2、I2的氧化性 | ||
| C. | 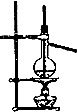 分离乙醇和水 | D. | 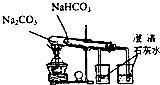 比较Na2CO3、NaHCO3的热稳定性 |
科目:高中化学 来源: 题型:选择题
| A. | 锌是负极,氧化银是正极 | |
| B. | 锌发生还原反应,氧化银发生氧化反应 | |
| C. | 溶液中OH-向正极移动,K+、H+向负极移动 | |
| D. | 随着电极反应的不断进行,电解质溶液的pH逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;取0.2mol/L的NaOH溶液与0.1mol/L的M溶液等体积混合,加热至充分反应后,待恢复至室温,剩余溶液中离子浓度由大到小的顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),此时测得溶液的pH=12,则此条件下M溶液中阴离子的电离平衡常数Ka=4×10?12(提示:若涉及多元弱酸的电离或多元弱酸根离子的水解,均只考虑第一步电离或水解)
;取0.2mol/L的NaOH溶液与0.1mol/L的M溶液等体积混合,加热至充分反应后,待恢复至室温,剩余溶液中离子浓度由大到小的顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),此时测得溶液的pH=12,则此条件下M溶液中阴离子的电离平衡常数Ka=4×10?12(提示:若涉及多元弱酸的电离或多元弱酸根离子的水解,均只考虑第一步电离或水解)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
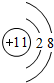 .
.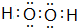 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性Cl-、Br-、I- | B. | 碱性:Na0H、Mg(OH)2、Al(OH)3 | ||
| C. | 稳定性HCl、H2S、PH3 | D. | 酸性:HC1O4、H2SO4、H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
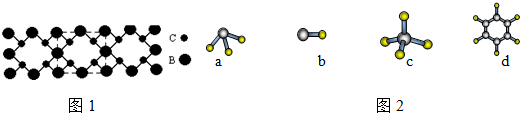
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com