
【题目】现有四种元素的基态原子的电子排布式如下:①![]() ;②
;②![]() ;③
;③![]() ;④
;④![]() 则下列有关比较中正确的是
则下列有关比较中正确的是![]()
A.第一电离能:③>②>④>①
B.原子半径:①>②>④>③
C.电负性:③>①>②>④
D.最高正化合价:③>①>②>④
【答案】C
【解析】
由四种元素基态原子电子排布式可知,![]() 为S元素,
为S元素,![]() 为P元素,
为P元素,![]() 为F元素、
为F元素、![]() 是Si元素。
是Si元素。
A、同周期自左而右基态原子的第一电离能呈增大趋势,但P元素原子3p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,所以第一电离能![]() ,同主族自上而下第一电离能降低,所以第一电离能
,同主族自上而下第一电离能降低,所以第一电离能![]() ,所以第一电离能
,所以第一电离能![]() ,即:
,即:![]() ,故A错误;
,故A错误;
B、同周期主族元素原子半径自左而右减小,所以原子半径![]() ,电子层越多原子半径越大,所以原子半径F最小,故原子半径
,电子层越多原子半径越大,所以原子半径F最小,故原子半径![]() ,即
,即![]() ,故B错误;
,故B错误;
C、同周期自左而右电负性增大,所以电负性![]() ,同主族从上到下电负性减弱,所以电负性
,同主族从上到下电负性减弱,所以电负性![]() ,故电负性
,故电负性![]() ,即
,即![]() ,故C正确;
,故C正确;
D、最高正化合价等于最外层电子数,但F元素没有正化合价,所以最高正化合价:![]() ,故D错误;
,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】1,4-二氧六环的一种合成方法如下,下列说法正确的是
CH2=CH2![]()
![]()
![]()
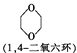
A.反应①、②的原子利用率均为100%
B.反应②的反应类型是加成聚合反应
C.环氧乙烷分子中的所有原子处于同一平面
D.与1,4-二氧六环互为同分异构体的酯类只有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液是中学化学的重点研究对象。
(1)水是极弱的电解质,也是最重要的溶剂。常温下某电解质溶解在水中后,溶液中的c(H+)=10-9 mol·L-1,则该电解质可能是____(填序号)。
A.CuSO4 B.HCl C.Na2S D.NaOH E.K2SO4
(2)已知次氯酸是比碳酸还弱的酸,要使新制稀氯水中的c(HClO)增大,可以采取的措施为(回答两种)____,_____。
(3)常温下,将pH=3的盐酸aL分别与下列三种溶液混合,结果溶液均呈中性。
①浓度为1.0×10-3mol·L-1的氨水bL;
②c(OH-)=1.0×10-3mol·L-1的氨水cL;
③c(OH-)=1.0×10-3mol·L-1的氢氧化钡溶液dL
则a、b、c、d之间的大小关系是___。
(4)已知:H2A=H++HA-,HA-![]() H++A2-。常温下,0.1mol·L-1的NaHA溶液其pH=2,则0.1mol·L-1的H2A溶液中氢离子浓度的大小范围是___<c(H+)<___;NaHA溶液中各种离子浓度大小关系为____。
H++A2-。常温下,0.1mol·L-1的NaHA溶液其pH=2,则0.1mol·L-1的H2A溶液中氢离子浓度的大小范围是___<c(H+)<___;NaHA溶液中各种离子浓度大小关系为____。
(5)已知:Ksp(AgCl)=1.8×10-10,向50 mL0.018mol·L-1的AgNO3溶液中加入相同体积0.020mol·L-1的盐酸,所得混合溶液的pH=___,c(Ag+)=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。则下列说法错误的是( )

A. b电极是阴极B. a电极与电源的正极相连
C. 电解过程中水是氧化剂D. b电极附近溶液的pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
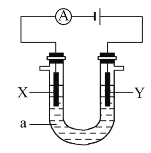
请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为_______,在X极附近观察到的现象是_________
②Y电极上的电极反应式为_____________ 检验该电极反应产物的方法及现象是__________
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是_________________电极反应式是_________________。
②Y电极的材料是___________电极反应式是__________________。(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0 mol PCl3和1.0 mol Cl2充入体积不变得密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)![]() PCl5(g),达平衡时,PCl5为0.4mol,如果此时再充入2.0mol PCl3和1.0mol Cl2,再相同温度下再达平衡时PCl5的物质的量是( )
PCl5(g),达平衡时,PCl5为0.4mol,如果此时再充入2.0mol PCl3和1.0mol Cl2,再相同温度下再达平衡时PCl5的物质的量是( )
A.0.4molB.0.8mol
C.大于0.8molD.大于0.4mol,小于0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肯定属于同族元素且性质相似的是
A. A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子
B. 结构示意图:A为 ![]() ,B为
,B为![]()
C. A原子基态时2p轨道有1个未成对电子,B原子基态时3p轨道也有1个未成对电子
D. 原子核外电子排布式:A为1s22s2,B为1s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硝酸锶[化学式:Sr(NO3)2]用于制造信号灯、光学玻璃等。
⑴工业级硝酸锶中常含有硝酸钙、硝酸钡等杂质,其中硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸。请结合相关信息,补充完整提纯硝酸锶的下列实验步骤:
①取含杂质的硝酸锶样品,_____,搅拌。
②_____。
③将滤渣溶于水中,加略过量铬酸使Ba2+沉淀,静置后加入肼(N2H4)将过量铬酸还原,调节pH=7~8,过滤。
④将滤液用硝酸调节pH=2~3,_____,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
⑵Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500 ℃时Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到5.20 g SrO固体和5.08 g混合气体。计算该样品中Sr(NO3)2的质量分数_________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡元素Ti、Mn、Fe、Cu等可与C、H、O形成多种化合物。请回答下列问题:
(1)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Mn属于___区。
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。基态Ti2+中电子占据的最高能层符号为___,该能层具有的原子轨道数为___,BH4-的空间构型是___。
(3)在Cu的催化作用下,乙醇可被空气中氧气氧化为乙醛,乙醛分子中碳原子的杂化方式是___,乙醛分子中HCO的键角___乙醇分子中H-C-O的键角(填“大于”、“等于”或“小于”)。
(4)电镀厂排放的废水中常含有剧毒的CN-,可在TiO2的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2。
①H、C、N、O四种元素的电负性由小到大的顺序为___。
②与CN-互为等电子体微粒的化学式为___(写出一种即可)。
(5)单质铁有δ、γ、α三种同素异形体,三种晶胞中Fe原子的配位数之比为___,δ、γ、α三种晶胞的边长之比为___。
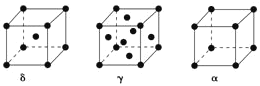
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com