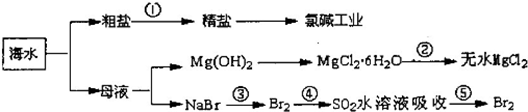
��2010?�ij�ģ�⣩���ô�������Ӧ��SO
2ת��ΪSO
3�ǹ�ҵ����������Ĺؼ����裮
��֪��SO
2+
O
2?SO
3��H=-98KJ?mol
-1��1����T
1�¶�ʱ���÷�Ӧ��ƽ�ⳣ��
K=�����ڴ��¶��£���100L�ĺ����ܱ������У�����3.0molSO
2��16.0molO
2��3.0molSO
3����Ӧ��ʼʱ����Ӧ����
��
��
�淴Ӧ���ʣ����������������=������
��2����T
2�¶�ʱ����ʼ��100L���ܱ������м���4.0molSO
2��10.0molO
2��һ�������µ���Ӧ�ﵽƽ��ʱ���ų�����196kJ����ʱ���������ת����Ϊ
50%
50%
��
��3���ڣ�2���еķ�Ӧ�ﵽƽ��ı�������������ʹSO
2ƽ��Ũ�ȱ�ԭ����С����
AC
AC
������ĸ����
A�������¶Ⱥ�����������䣬����1.0molO
2B�������¶Ⱥ�������ѹǿ���䣬����2.0molSO
2��5.0molO
2C�������¶�
D����������������ʱ����С�������ݻ�
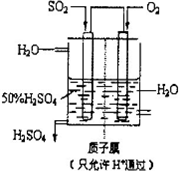
��4��������������ͼ��ʾװ���õ绯ѧԭ���������ᣬд��ͨ��SO
2�ĵ缫�ĵ缫��Ӧʽ��
SO2+2H2O=SO42-+4H++2e-
SO2+2H2O=SO42-+4H++2e-
��
��5����������Ƶ������Σ���һ���¶��£���K
2SO
4��Һ�еμ�Na
2CO
3��Һ��BaCl
2��Һ�������ֳ�������ʱ��
=
40
40
��[��֪���¶�ʱ��
KSP(BaSO4)=1.3��10-10��
KSP(BaCO3)=5.2��10-9]��

 ��2010?�ij�ģ�⣩���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����裮
��2010?�ij�ģ�⣩���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����裮

 Сѧ��ʱ��ѵϵ�д�
Сѧ��ʱ��ѵϵ�д�