
 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:分析 (1)Al、Cu、稀硫酸构成的原电池,金属铝做负极,金属铜为正极,正极上氢离子得电子生成氢气;
(2)自发的氧化还原反应能设计成原电池,失电子的极是负极;
(3)燃料电池中,甲烷燃料通在负极,正极是氧气得电子,电子从负极流向正极.
解答 解:(1)Al、Cu、稀硫酸构成的原电池,金属铝做负极,金属铜为正极,正极上氢离子得电子生成氢气,正极的电极反应为:2H++2e-=H2↑,
故答案为:2H++2e-=H2↑;
(2)Fe、Cu、浓硝酸之间.金属Fe遇到浓硝酸会钝化,Cu与浓硝酸反应,则能设计成原电池,失电子的是金属铜,为负极,金属铁为正极,负极反应式为:Cu-2e-=Cu2+;
故答案为:能;Cu-2e-=Cu2+;
(3)氢氧燃料电池中,燃料甲烷需通在负极,正极是氧气得电子,电子从负极流向正极,负极上甲烷失电子生成二氧化碳,则负极电极方程式为:CH4+2H2O-8e-=CO2+8H+;
故答案为:b;负;CH4+2H2O-8e-=CO2+8H+.
点评 本题考查原电池原理,为高频考点,把握原电池的工作原理、正负极的判断和电极方程式的书写方法为解答的关键,侧重电极、电极反应、电子转移的考查,题目难度不大.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 称取5.1 g Na2CO3,加入500 mL水 | |
| B. | 称取13.7 g Na2CO3•10H2O,配成500 mL溶液 | |
| C. | 称取5.3 Na2CO3,加入500 mL水 | |
| D. | 称取14.3 g Na2CO3•10H2O,配成500 mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③⑤ | C. | ①②④ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
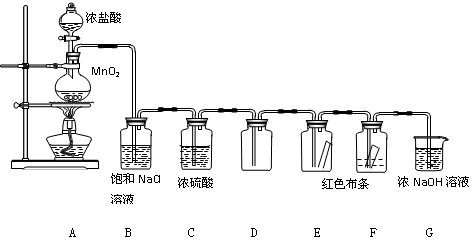
 某兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 与足量NaOH溶液反应的化学方程式为CH3CBr(COOH)CH3+2NaOH→CH3C(OH)(COONa)CH3+NaBr+H2O.
与足量NaOH溶液反应的化学方程式为CH3CBr(COOH)CH3+2NaOH→CH3C(OH)(COONa)CH3+NaBr+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | C的体积分数下降 | ||
| C. | x+y<z | D. | B的转化率降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6LO2与5.6LNO混合后的分子总数为0.5NA | |
| B. | 标准状况下,22.4L C6H6分子中含有6NA个C-C单键 | |
| C. | 7.8克过氧化钠中含0.2NA阳离子和0.1NA阴离子 | |
| D. | 在500mL0.1mol•L-1NaAlO2溶液中AlO2-?数为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
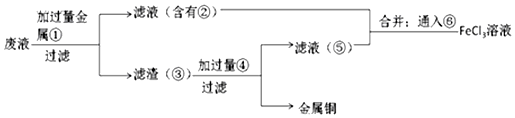
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com