
| A. | 步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42-离子浓度增大 | |
| B. | 步骤①中当溶液呈现深黄色,且2v(CrO${\;}_{4}^{2-}$)=v(Cr2O72-)时,说明反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O 达到平衡状态 | |
| C. | 步骤②中,若要还原1 mol Cr2O${\;}_{7}^{2-}$离子,需要6 mol(NH4)2Fe(SO4)2•6H2O | |
| D. | 步骤③中,当将溶液的pH 调节至4 时,可认为废水中的铬元素已基本除尽 |
分析 A.步骤①中加酸,氢离子浓度增大,平衡正向移动;
B.2v(CrO42-)=v(Cr2O72-)时,正逆反应速率不等;
C.还原1 mol Cr2O72-离子,转移电子为1mol×2×(6-3)=6mol,Fe元素的化合价由+2升高为+3;
D.步骤③中,当将溶液的pH 调节至4 时,c(OH-)=10-10mol/L,结合Ksp计算.
解答 解:A.步骤①中加酸,氢离子浓度增大,平衡正向移动,则CrO42-离子浓度减小,故A错误;
B.2v(CrO42-)=v(Cr2O72-)时,正逆反应速率不等,则该反应不能达到平衡,故B错误;
C.还原1 mol Cr2O72-离子,转移电子为1mol×2×(6-3)=6mol,Fe元素的化合价由+2升高为+3,则由电子守恒可知需要6 mol(NH4)2Fe(SO4)2•6H2O,故C正确;
D.步骤③中,当将溶液的pH 调节至4 时,c(OH-)=10-10mol/L,由Ksp可知,c(Cr3+)=$\frac{1{0}^{-32}}{(1{0}^{-10})^{3}}$=10-2mol/L,废水中的铬元素没有除尽,故D错误;
故选C.
点评 本题考查化学平衡的影响因素,涉及反应速率、平衡移动、转移电子计算、溶解度计算等,注重学生知识迁移应用能力的考查,题目难度中等.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 在容量瓶中溶解氢氧化钠固体并配制溶液 | |
| B. | 用100mL的量筒量取5.2mL的盐酸 | |
| C. | 用托盘天平称取25.2gNaCl | |
| D. | 用分液漏斗来过滤NaCl溶液中泥沙 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
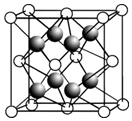 (1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是B.
(1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是B.| 电离能/kJ•mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色透明的溶液中:Na+、SO42-、MnO4-、NO3- | |
| B. | 使无色酚酞试液呈红色的溶液中:Na+、Cu2+、SO42-、Cl- | |
| C. | pH=1的溶液中:K+、ClO-、S2-、Cl- | |
| D. | 弱碱性的溶液中:Na+、K+、HCO3-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)?CH3OH(g)△H=a kJ•mol-1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)?CH3OH(g)△H=a kJ•mol-1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验次 序编号 | 盐酸溶液体积 V/mL | 氢氧化钠溶液体积 V/mL |
| 1 | 19.90 | 10.00 |
| 2 | 20.10 | 10.00 |
| 3 | 22.00 | 10.00 |
| 4 | 20.00 | 10.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
| 滴定前的刻度 (mL) | 滴定后的刻度 (mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
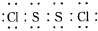 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如表:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如表:| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |
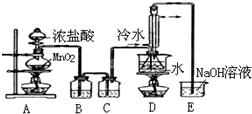
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com