
 已知反应:2SO2(g)+O2(g)?2SO3(g)△H<0.一定温度下,在容积为2L的甲、乙、丙三个恒温密闭容器中,充入的SO2(g)和O2(g)的量如图所示:
已知反应:2SO2(g)+O2(g)?2SO3(g)△H<0.一定温度下,在容积为2L的甲、乙、丙三个恒温密闭容器中,充入的SO2(g)和O2(g)的量如图所示:| A. | 三个容器中的反应速率相同 | |
| B. | 丙中的平衡常数最大,甲中最小 | |
| C. | 当容器甲中SO2的转化率为80%时,该反应的平衡常数为160 | |
| D. | 达到平衡时,容器丙中的c(SO3)是容器甲中的两倍 |
分析 A.反应物浓度不同,反应速率不同;
B.相同温度下,平衡常数相同;
C.计算平衡浓度,结合K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$计算;
D.丙物质的量为甲的二倍,可看在在甲的基础上缩小体积为原来的一半.
解答 解:A.甲、乙、丙三容器中反应物浓度不同,则反应速率不同,故A错误;
B.平衡常数只受温度的影响,相同温度下,平衡常数相同,故B错误;
C.已知:2SO2(g)+O2(g)?2SO3(g)
开始 1mol 0.6mol 0
转化 0.8mol 0.4mol 0.8mol
平衡 0.2mol 0.2mol 0.8mol
又体积为2L,则浓度分别为c(SO3)=0.4moL/L,c(SO2)=0.1mol/L,c(O2)=0.1moL/L,
K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$=$\frac{0.{4}^{2}}{0.{1}^{2}×0.1}$=160,故C正确;
D.丙物质的量为甲的二倍,可看在在甲的基础上缩小体积为原来的一半,增大压强,平衡正反应方向移动,则容器丙中的c(SO3)大于容器甲中的2倍,故D错误.
故选C.
点评 本题考查物质的量有关计算,侧重于学生的分析、计算能力的考查,为高频考点,题目比较基础,旨在考查学生对基础知识的巩固,注意理解掌握三段式解题法.


 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 新制氯水只含有氯分子和次氯酸分子 | |
| B. | 新制氯水可使紫色石蕊试液先变红后褪色 | |
| C. | 氯水光照时有气泡逸出,该气体的主要成分是氯气 | |
| D. | 氯水放置数天后,其酸性逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 | |
| C. | 天然纤维和合成纤维的主要成分都是纤维素 | |
| D. | 海水淡化的方法有蒸馏法、电渗析法等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | A的转化率变小 | B. | 平衡向逆反应方向移动 | ||
| C. | D的体积分数变大 | D. | a+b>c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,有关该晶体的说法正确的是
,有关该晶体的说法正确的是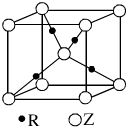
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
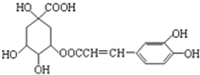 咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示,关于咖啡鞣酸的下列叙述正确的是( )
咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示,关于咖啡鞣酸的下列叙述正确的是( )| A. | 分子式为C16H13O9 | |
| B. | 与浓溴水既能发生取代反应又能发生加成反应 | |
| C. | 1 mol咖啡鞣酸水解时可消耗8 mol NaOH | |
| D. | 能使酸性KMnO4溶液褪色,说明分子结构中有碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打在生活中可用做发酵粉 | |
| B. | 过氧化钠可用于呼吸面具中氧气的来源 | |
| C. | 可溶性铁盐或铝盐可用于净水 | |
| D. | 二氧化硅可用于制作硅芯片和光电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3mol A,2mol B | 6molA.4mol B | 2mol C |
| 达到平衡的时间/时间 | 5 | 8 | |
| A的平衡浓度/mol•L-1 | c1 | c2 | |
| C的体积分数/% | ω1 | ω2 | ω3 |
| 混合气体的密度/g•L-1 | ρ1 | ρ2 |
| A. | 若x>4,2c1<c2 | |
| B. | 若x=4,则ω1=ω2=ω3 | |
| C. | 只有当x=4时,2ρ1=ρ2 | |
| D. | 容器甲达到平衡所需的时间比容器乙达到平衡所需的时间长 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com