
【题目】Ⅰ.氢气是重要的化学试剂、化工原料和有广阔发展前景的新能源。以甲醇为原料制备氢气的一种原理如下:
i. CH3OH(g) ![]() CO(g)+ 2H2(g) △H =+90kJ·mol-1
CO(g)+ 2H2(g) △H =+90kJ·mol-1
ii. CO(g)+H2O(g)![]() CO2(g)+ H2(g) △H =-41kJ·mol-1
CO2(g)+ H2(g) △H =-41kJ·mol-1
(1)向VL 恒容密闭容器中充入lmol CH3OH(g),发生反应i。图I中能正确表示CHOH(g)的平衡转化率(a)随温度(T) 变化关系的曲线为_______________(填“A”或“B”)。T1℃时,体系的平衡压强与起始压强之比为_________________________。

(2)起始向10L 恒容密闭容器中充入lmol CH3OH(g)和1molH2O(g),发生反应i和反应ii,体系中CO的平衡体积分数与温度(T)和压强(P)的关系如图2所示。
①P1、P2、P3由大到小的顺序为___________________。
②测得C点时、体系中CO2的物质的量为0.2mol,则T2℃时,反应ii 的平衡常数K=________。
Ⅱ.现有HA、HB 和H2C三种酸。室温下用0.1mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH 溶液体积的变化如图所示。
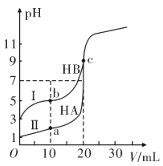
(1)a点时的溶液中由水电离出的c(H+)=________mol·L-1。
(2)与曲线I 上的c点对应的溶液中各离子浓度由大到小的顺序为_____________________________;
(3)已知常温下向0.1mol·L-1的NaHC 溶液中滴入几滴石蕊试液后溶液变成红色。
① 若测得此溶液的pH=1,则NaHC的电离方程式为_______________。
②若在此溶液中能检测到H2C 分子,则此溶液中c(C2-)________c(H2C)(填“>”“<”或“=”)。
③若H2C 的一级电离为H2C=H++ HC-,常温下0.1mol·L-1H2C溶液中的c(H+ )=0.11mol·L-1,则0.1mol·L-1NaHC溶液中的c(H+)________0.01mol·L-1(填“>”“<”或“=”)。
【答案】 B 9:5 P1>P2>P3 0.875 3×10-13 c(Na+)>c(B-)>c(OH-)>c(H+) NaHC=Na++H++C2- > >
【解析】Ⅰ. (1) CH3OH(g) ![]() CO(g)+2H2(g)△H =+90kJ·mol-1,升高温度,平衡正向移动,CHOH(g)的平衡转化率(a)增大,满足条件的是曲线B;T1℃时,CHOH(g)的平衡转化率为40%,则平衡时,CH3OH、CO、H2的物质的量分别为0.6mol、0.4mol、0.8mol,平衡压强与起始压强之比等于物质的量之比=
CO(g)+2H2(g)△H =+90kJ·mol-1,升高温度,平衡正向移动,CHOH(g)的平衡转化率(a)增大,满足条件的是曲线B;T1℃时,CHOH(g)的平衡转化率为40%,则平衡时,CH3OH、CO、H2的物质的量分别为0.6mol、0.4mol、0.8mol,平衡压强与起始压强之比等于物质的量之比=![]() =
=![]() ,故答案为:B;
,故答案为:B;![]() ;
;
(2)①ii. CO(g)+H2O(g)![]() CO2(g)+H2(g)改变压强,平衡不移动,i. CH3OH(g)
CO2(g)+H2(g)改变压强,平衡不移动,i. CH3OH(g) ![]() CO(g)+2H2,增大压强,平衡逆向移动,CO的平衡体积分数减小,因此P1、P2、P3由大到小的顺序为P1>P2>P3,故答案为:P1>P2>P3;
CO(g)+2H2,增大压强,平衡逆向移动,CO的平衡体积分数减小,因此P1、P2、P3由大到小的顺序为P1>P2>P3,故答案为:P1>P2>P3;
②i. CH3OH(g) ![]() CO(g)+2H2(g)
CO(g)+2H2(g)
起始(mol) 1 0 0
反应(mol) x x 2x
平衡(mol)1-x x 2x
ii. CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始(mol) x 1 0 2x
反应(mol)0.2 0.2 0.2 0.4
平衡(mol)x-0.2 0.8 0.2 2x+0.4
根据体系中CO的平衡体积分数为12.5%,有![]() =
=![]() ,解得x=0.6,则反应ii的平衡常数K=
,解得x=0.6,则反应ii的平衡常数K=![]() =0.875,故答案为:0.875;
=0.875,故答案为:0.875;
Ⅱ. (1)根据图像,0.1mol·L-1的HA的pH=1,说明HA为强酸,完全电离,a点时的溶液中含有等物质的量浓度的HA和NaA,溶液的体积为30mL,此时c(H+)=![]() =
=![]() mol/L,则c(OH-)=
mol/L,则c(OH-)=![]() =
=![]() =3×10-13 mol/L,故答案为:3×10-13;
=3×10-13 mol/L,故答案为:3×10-13;
(2)根据图像,0.1mol·L-1的HB的pH=3,说明HB为弱酸,c点恰好生成NaB,水解,溶液显碱性,溶液中各离子浓度由大到小的顺序为c(Na+)>c(B-)>c(OH-)>c(H+),故答案为:c(Na+)>c(B-)>c(OH-)>c(H+);
(3)①常温下向0.1mol·L-1的NaHC溶液中滴入几滴石蕊试液后溶液变成红色,溶液呈酸性,若测得此溶液的pH=1,说明NaHC完全电离,电离方程式为NaHC=Na++H++C2-,故答案为:NaHC=Na++H++C2-;
②常温下向0.1mol·L-1的NaHC溶液中滴入几滴石蕊试液后溶液变成红色,溶液呈酸性,若在此溶液中能检测到H2C分子,说明NaHC的电离程度大于水解程度,则此溶液中c(C2-)>c(H2C) ,故答案为:>;
③若H2C的一级电离为H2C=H++HC-,常温下0.1mol·L-1H2C溶液中的c(H+)=0.11mol·L-1,H2C的一级电离产生的氢离子会抑制HC-的电离,抑制后HC-电离的c(H+)=0.01mol·L-1,则0.1mol·L-1NaHC溶液中的c(H+)>0.01mol·L-1,故答案为:>。


科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是( )
A. 含有4molHCl的浓盐酸与足量MnO2反应,生成1molCl2
B. 78g Na2O2与足量水充分反应时电子转移数为2NA
C. 标准状况下,22.4L SO3中所含的SO3分子数为NA
D. 常温常压下,8g O2所含的质子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列叙述正确的是
A. 若V1L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合后显中性,则V1≤V2
B. 等体积、等物质的量浓度的NaCl溶液中离子总数大于NaClO溶液中离子总数
C. 等体积、等物质的量浓度的Na2CO3和NaHCO3溶液混合:![]() <
<![]()
D. 将CH3COOH溶液与NaOH溶液混合,若混合后的溶液中c(CH3COO-)+c(CH3COOH)=2c(Na+),则c(OH-)+c(CH3COO-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常采用高锰酸钾加热分解法制取氧气,某兴趣小组经查阅资料获知:制得氧气后固体残余物中的锰酸钾(K2MnO4)具有强氧化性,与还原剂、有机物、易燃物混合可形成爆炸性混合物,如不妥善处置将造成危险。因此该小组对该残余物进行分离提纯,得到锰酸钾晶体,利用回收的锰酸钾与浓盐酸反应制取氯气,并设计实验验证氯气化学性质。

(1)检验该套装置气密性的方法是:______________________________;
(2)打开分液漏斗活塞及弹簧夹2,观察到烧瓶壁有紫红色物质生成并逐渐消失,黄绿色气体充满烧瓶。反应结束后,烧瓶内有黑色固体残余,写出过程中发生的化学反应方程式:_________________________________________;
(3)该方法制取氯气比用纯净的高锰酸钾要缓和平稳许多,试分析原因:________;
(4)该小组利用装置C吸收氯气制备漂白粉。
①C中盛装的试剂为:________________________________;(写名称)
②陶瓷多孔球泡的作用是:_________________________________________________;
(5)测定漂白粉有效成分的质量分数:称取1.5g所制漂白粉配成溶液,调节pH值并加入指示剂,用0.1000mol/L KI溶液进行滴定,三次平行实验平均每次消耗20.00mL标准液时达到滴定终点。已知氧化性:ClO-> IO3-> I2
①所选的指示剂为:______________,到达滴定终点的标志是:______________________;
②该漂白粉中有效成分的质量分数为:__________________________。
(6)打开分液漏斗活塞及弹簧夹1,可观察到D中的现象为:______________;该现象能够证明氯气有氧化性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]乙基香兰素是最重要的合成香料之一,常作为婴幼儿奶粉的添加剂。制备乙基香兰素的一种合成路线(部分反应条件略去)如下图所示:

已知:① R—ONa + R’—Br —→ R—O—R’ + NaBr
② Ⅲ中生成的Cu2O经氧化后可以循环利用
回答下列问题:
(1)A的核磁共振氢谱有3组峰。A的结构简式为 。
(2)Ⅰ中可能生成的一种烃是 (填名称);催化剂PEG可看作乙二醇脱水缩聚的产物,PEG的结构简式为 。若PEG的平均相对分子质量为17618,则其平均聚合度约为 。
(3)Ⅱ中,发生的反应属于 (填反应类型)。
(4)Ⅲ中,反应的化学方程式为 。
(5)Ⅳ中,有机物脱去的官能团是 (填名称)。
(6)D是乙基香兰素的同分异构体,其分子结构中不含乙基。由A制备D的一种合成路线(中间产物及部分反应条件略去)如下图所示:
C和D的结构简式分别为 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是 ( )
A. 氢氧化亚铁在空气中的变化:2Fe(OH)2+O2+H2O=2Fe(OH)3
B. 硫酸亚铁溶液中加过氧化氢溶液:Fe2+ + 2H2O2 + 4H+=Fe3+ + 4H2O
C. 氢氧化铁与氢碘酸反应:Fe(OH)3+3HI=FeI3+3H2O
D. 硝酸铁溶液中加过量氨水:Fe3+ + 3NH3·H2O=Fe(OH)3 + 3NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学选修3:物质结构与性质】铝、铁在生活、生产中有着广泛的用途,请回答下列问题。
(1)Fe2+的最外层电子排布式____________。元素Fe与Mn的第三电离能分别为I3(Fe)、I3(Mn),则I3(Fe)______I3(Mn)(填“>”、“<")。
(2)第四周期中,与Al原子未成对电子数相同的金属元素有____种。气态氯化铝的分子组成为(AlCl3)2,其中Al、Cl均达8e-稳定结构,Al原子的杂化方式为__________。根据等电子原理,AlO2-的空间构型为_____。
(3)Fe(CO)5的熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为______,晶体中σ键和π键的数目之比为______。
(4)科学家们发现某些含铁的物质可催化尿素合成肼(N2H4),沸点:N2H4>C2H6的主要原因为____________。
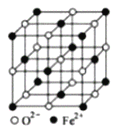
(5)FeO晶体的晶胞如图所示,己知:FeO晶体的密度为ρg/cm3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-最短核间距为______pm(用ρ和NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外实验小组从煤油中取出一块钠,用滤纸吸净其表面的煤油,用切刀切下数块,分别进行实验研究:
(1)切下的钠块表面变暗,其反应的化学方程式为________________。
(2)将一小块金属钠投入水中,发生反应的离子方程式为 ____________________;可观察到的实验现象是____________(填序号)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(3)将其中一块钠放入坩埚中加热,反应现象为: ______________________________,反应的化学方程式是________________________。
(4)过氧化钠是钠的一种重要化合物,其中一种用途是用于呼吸面具或潜水艇中氧气的来源,涉及的主要反应的化学方程式为_______________(写一个即可),若15.6gNa2O2参加反应,则最多可制得标准状况下氧气的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平.现以A为主要原料合成乙酸乙酯,其合成路线如图1所示.
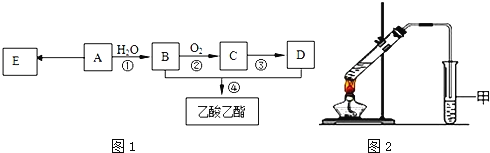
(1)A分子中官能团的名称是______,D中官能团的名称是______;反应①的反应类型是______反应.
(2)反应②的化学方程式是______,反应④的化学方程式是______.
(3)E是常见的高分子材料,合成E的化学方程式是______.
(4)某同学用如图2所示的实验装置制取少量乙酸乙酯.实验结束后,试管甲中上层为透明的、不溶于水的油状液体.
①实验开始时,试管甲中的导管不伸入液面下的目的是______.
②上述实验中饱和碳酸钠溶液的作用是(填字母)______.
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.加速酯的生成,提高其产率
D.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com