
【化学——选修物质结构与性质】(15分)
原子序数依次递增的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期。已知
X的最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼
铁;Z与X同主族,其单质在同周期元素形成的单质中熔点最高;W原子M能层为全充满
状态,且核外的未成对电子只有一个。回答下列问题:
(1)从电负性角度分析,X,Y,Z三种元素的非金属活泼性由强到弱的顺序为 。
(2)X、Y分别与H形成的化学键的极性关系为X-H Y-H(填“<”、“>”或“=”)。
(3)+l价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二
电离能I2,依次还有I3、I4、I5…,推测Z元素的电离能突增应出现在第____电离能。
(4)X的氢化物中X原子的杂化方式为sp2,则相对分子质量最小的分子式为____,
(5)W的价电子排布图为 ;下图____表示的是W晶体中微粒的堆积方式(填甲、乙或丙);若W晶体中一个晶胞的边长为a cm,则W晶体的密度为____(写出含a的表达式,用NA表示阿伏伽德罗常数)。
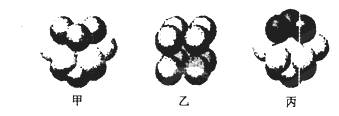
【知识点】物质结构与元素周期律 E4 E2 E3 N1 N3 N4
【答案解析】(1)O>C >Si (2分)
(2)< (2分)
(3)第五 (2分)
(4)C2H4,(2分)
 (5) (2分) 丙(2分)
(5) (2分) 丙(2分) 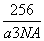 g/cm3(3分)
g/cm3(3分)
解析:(1)根据X的最外层电子数是其内层电子数的2倍知X是C,X、Y同周期,X与Y形成的常见化合物之一常被用于高炉炼铁推出Y是O,Z与X同主族,则Z是Si,W是Cu元素,X,Y,Z三种元素的非金属性由强到弱的顺序为O>C >Si。(2)由于O元素的电负性大于C元素,因此键的极性C-H < O-H(3)Si的最外层电子数为4,因此第五个电子失去会出现电离能突增。(4)C原子以sp2方式杂化,则应该形成碳碳双键,所以最小分子式为C2H4, (5)Cu的价电子排布3d104s1,其晶体中微粒的堆积方式为面心立方最密堆积,选择丙。用均摊法推知面心立方最密堆积Cu晶体中一个晶胞含有4个Cu原子,则一个晶胞的质量是4×64/NA,一个晶胞的体积是a3cm3,因此其密度为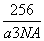 g/cm3。
g/cm3。
【思路点拨】根据元素的性质、原子结构特点找出元素推断的突破口;根据元素周期律进行解答;有关晶胞的计算往往涉及均摊法:(1)处于顶点的粒子,同时为8个晶胞所共有,每个粒子有1/8属于该晶胞(2)处于棱上的粒子,同时为4个晶胞共有,每个粒子有1/4属于该晶胞(3)处于面上的粒子,同时为2个晶胞共有,每个粒子有1/2属于该晶胞(4)处于晶胞内部的粒子,则完全属于该晶胞。


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
反应:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g)在10 L 密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均速率
4NO(g)+6H2O(g)在10 L 密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均速率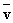 (X)可表示为( )
(X)可表示为( )
A.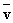 (NH3)=0.010 mol·L-1·s-1
(NH3)=0.010 mol·L-1·s-1
B.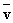 (O2)=0.001 0 mol·L-1·s-1
(O2)=0.001 0 mol·L-1·s-1
C.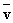 (NO)=0.001 0 mol·L-1·s-1
(NO)=0.001 0 mol·L-1·s-1
D.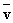 (H2O)=0.045 mol·L-1·s-1
(H2O)=0.045 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式错误的是( )
A.实验室制Cl2:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B.在NaCl溶液中滴入AgNO3试液:Ag++Cl-===AgCl↓
C.Cl2溶于水:Cl2+H2O===2H++Cl-+ClO-
D.用NaOH溶液吸收Cl2:Cl2+2OH-===Cl-+ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知: ,从A出发发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体。
,从A出发发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体。
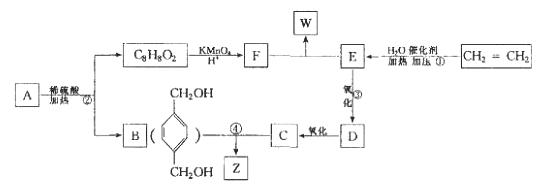
回答下列问题:
(1)写出反应类型:①_____________________,②______________________________。
(2)写出下列反应的化学方程式:
③_____________________________________________________;
④_____________________________________________________。
(3)与B互为同分异构体,属于酚类且苯环上只有两个互为对位取代基的化合物有4种,其结构简式为_______________,_________________,_______________,______________。
(4)A的结构简式可能为_______________________________________(只写一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质:
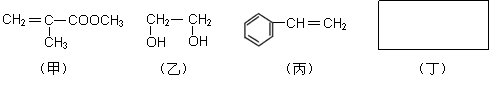 |
(1)丙的名称是____________;乙中官能团的名称是 。
(2)写出甲和丙聚合得到高聚物的结构简式 。
(3)化合物丁的分子式为C6H6O2,只含两种化学环境的氢原子,遇FeCl3溶液呈现特征颜色。写出丁与足量碳酸钠溶液反应的化学方程式 。
(4)下列试剂中与上述四种物质都能发生反应的是___________(填写编号)。
a. Br2的CCl4溶液 b. 石蕊溶液 c. 酸性KMnO4溶液 d. O2
查看答案和解析>>
科目:高中化学 来源: 题型:
为解决日益加剧的温室效应等问题,科学家正在研究建立如下图所示的二氧化碳新循
环体系:
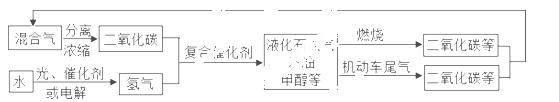
上述关系图能反映的化学观点或化学思想有:( )
①化学变化中元素种类是守恒的;②燃烧时化学能可以转化为热能和光能;③光能或电能可以转化为化学能;④无机物和有机物可以相互转化;⑤二氧化碳也是一种重要的资源.
A.①②③ B.①②④⑤ C.①④⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
现有部分元素的性质与原子(或分子)结构如下表:
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的简单阳离子中半径最小 |
(1)写出元素T的原子结构示意图:_______________________________________ .
.
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填序号).
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既含离子键又含非极性共价键的化合物,写出该化 合物的电子式:_________________________________________________.
合物的电子式:_________________________________________________.
(4)元素T和元素X以原子个数比2∶1化合形成化合物Q,元素X与氢元素 以原子个数比1∶2化合形成常用于火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式___________________________.
以原子个数比1∶2化合形成常用于火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式___________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是 ( )
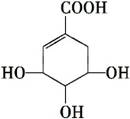
莽草酸
A.分子式为C7H6O5
B.分子中含有2种官能团
C.可发生加成和取代反应
D.在水溶液中羧基和羟基均能电离出H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com