
| A.二氧化硅可用作半导体材料 | B.硝酸常用作金属铜加工前的酸洗 |
| C.碳酸钠可用于治疗胃酸过多 | D.三氧化二铁常用于生产红色油漆和涂料 |
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验 | 现象 | 解释或结论 |
| A | 加入FeCl3固体 | 溶液变成红褐色 | FeCl3的水解程度变大 |
| B | 加入等体积水 | 溶液颜色变浅 | c(Fe3+)变小 |
| C | 加入足量Fe粉 | 溶液颜色变成浅绿色 | 2Fe3++Fe=3Fe2+ |
| D | 将FeCl3溶液微热 | 溶液变成红褐色 | 水解反应ΔH>0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只有①或② | B.只有②或④ |
| C.只有①或②或③ | D.上述四种物质中任意一种 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
|
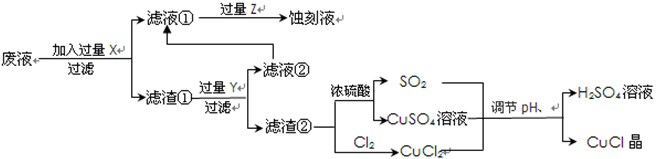 根据以上信息回答下列问题:
根据以上信息回答下列问题:| | 1 | 2 | 3 |
| 空白实验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应后的溶液中加入氯水不变色 |
| B.反应后的溶液可继续溶解金属铜 |
C.原混台物中氧化铁的物质的量为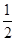 (a-b)mol (a-b)mol |
| D.原混合物中单质铁的物质的量为b mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通过化合反应可制得FeCl2和Fe(OH)3 |
| B.铁是较活泼的金属,不能用铁质容器储存、运输浓硝酸、浓硫酸 |
| C.不锈钢是铁的合金,只含金属元素 |
| D.Fe3O4俗称铁红 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
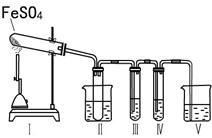
| A.2 mol/LNa2CO3溶液 |
| B.品红溶液 |
| C.0.5 mol/LBaCl2溶液 |
| D.0.5 mol/LBa(NO3)2 |
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入 。 | | 固体中含有Fe2O3 |
| 向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液。 | 产生蓝色沉淀 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
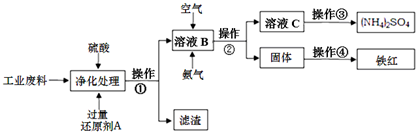
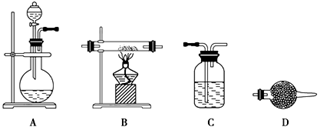
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
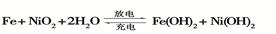
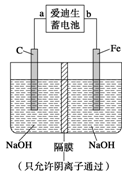
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com