

分析 (1)N原子的核电荷数=核外电子总数=7,最外层含有7个电子;
(2)NO和NO2分子分别含有1个O原子、2个O原子,含有相同氧原子数的NO和NO2,物质的量比为2:1,根据m=nM计算二者质量之比;根据二者含有电子数计算出电子数目之比;
(3)在水溶液中或熔化状态上能导电的化合物称为电解质,在上述两种情况下都不能导电的化合物称为非电解质,据此进行解答.
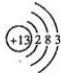
解答 解:(1)N原子的核电荷数、核外电子总数都是7,其原子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)NO和NO2分子分别含有1个O原子、2个O原子,含有相同氧原子数的NO和NO2,二者物质的量比为2:1,二者质量之比=2mol×30g/mol:1mol×46g/mol=30:23;二者含有电子数之比=含有电子的物质的量之比=(15×2):(23×1)=30::23,
故答案为:2:1; 30:23;30:23;
(3)根据电解质的定义,在水溶液中或熔化状态上能导电的化合物称为电解质,在上述两种情况下都不能导电的化合物称为非电解质,所以在上述物质中属于电解质的是②⑥,即B正确;属于非电解质的是⑧⑨⑩,即D正确,
故答案为:B;D.
点评 本题考查了物质的量的计算、电解质与非电解质的判断及原子结构示意图等知识,题目难度中等,注意掌握物质的量与其它物理量之间的关系,明确电解质与非电解质的判断方法,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | Q1>Q3>Q2 | B. | Q1>Q2>Q3 | C. | Q2>Q1>Q3 | D. | Q3>Q1>Q2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
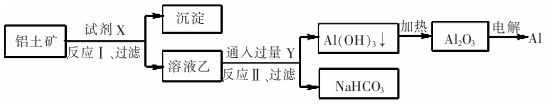
| A. | 试剂X为稀硫酸 | |
| B. | 反应Ⅱ中生成Al(OH)3的反应为:CO2+AlO2-+2H20=Al(OH)3↓+HCO3一 | |
| C. | 结合质子( H+)的能力由强到弱的顺序是Al02->CO32->OH- | |
| D. | Al2O3熔点很高,工业上还可采用电解熔融AICl3冶炼Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;Al与NaOH溶液反应的离子方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
;Al与NaOH溶液反应的离子方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 酸碱中和在化工生产中有着重要应用.
酸碱中和在化工生产中有着重要应用.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
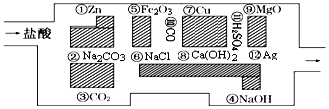
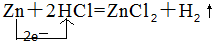 .其中氧化剂是HCl,还原剂是Zn.
.其中氧化剂是HCl,还原剂是Zn.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
| Ⅰ | 7.4 | 40.00 | 1.68 |
| Ⅱ | 14.8 | 40.00 | 3.36 |
| Ⅲ | 22.2 | 40.00 | 1.12 |
| Ⅳ | 37.0 | 40.00 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com