
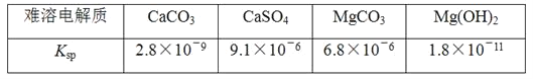
【题目】已知难溶电解质在水溶液中存在溶解平衡MmAn(s)![]() mMn+(aq)+nAm-(aq),Ksp=cm(Mn+)·cn(Am-)称为溶度积。
mMn+(aq)+nAm-(aq),Ksp=cm(Mn+)·cn(Am-)称为溶度积。
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料(25℃):
他们的实验步骤如下:
①往100mL0.1mol·L-1的CaCl2溶液中加入0.1mol·L-1的Na2SO4溶液100mL立即有白色沉淀生成。
②向上述悬浊液中加入固体Na2CO33g,搅拌,静置后弃去上层清液。
③再加入蒸馏水搅拌,静置后再弃去上层清液。
④___________________________。
(1)由题中信息知Ksp越大,表示电解质的溶解度越__(填“大”或“小”)。
(2)写出第②步发生反应的化学方程式__。
(3)设计第③步的目的是什么__。
(4)请补充第④步操作及发生的现象__。
(5)请写出该转化在实际生活、生产中的一个应用__。
【答案】大 Na2CO3(aq)+CaSO4(s)![]() CaCO3(s)+Na2SO4(aq) 洗去沉淀上附着的SO42- 向沉淀中加入足量的盐酸,沉淀完全溶解,有气泡产生 将锅炉水垢中的CaSO4转化为CaCO3,易于除去
CaCO3(s)+Na2SO4(aq) 洗去沉淀上附着的SO42- 向沉淀中加入足量的盐酸,沉淀完全溶解,有气泡产生 将锅炉水垢中的CaSO4转化为CaCO3,易于除去
【解析】
(1)根据Ksp的含义分析;
(2)硫酸钙与碳酸钠反应生成碳酸钙沉淀;
(3)上层清液里有Na2SO4,所以沉淀上有附着的硫酸根离子,要洗去;
(4)检验生成的沉淀是不是碳酸钙;
(5)工厂大型锅炉除水垢的方法;
(1)Ksp越大,饱和溶液中离子的浓度越大,电解质的溶解度越大;
(2)根据表格数据,硫酸钙的Ksp比碳酸钙大,当加入碳酸钠时会反应生成碳酸钙沉淀,其反应方程式为:Na2CO3(aq)+CaSO4(s)=Na2SO4(aq)+CaCO3(s);
(3)上层清液里有Na2SO4,故应洗去沉淀上附着的SO42;
(4)因为前面加入了固体Na2CO3,生成CaCO3,向沉淀中加入足量的盐酸,如果沉淀完全溶解并放出无色无味气体,说明该沉淀是碳酸钙,说明CaSO4加入碳酸钠后生成了碳酸钙;
(5)在实际生活生产中,利用沉淀的转化可将锅炉水垢中的CaSO4转化为CaCO3,再用盐酸溶解除去。


科目:高中化学 来源: 题型:
【题目】我国科学家成功研制出铝-石墨烯(![]() )可充电电池,电解质为阳离子(
)可充电电池,电解质为阳离子(![]() )与阴离子(
)与阴离子(![]() )组成的离子液体,该电池放电过程如右图所示。下列说法错误的是
)组成的离子液体,该电池放电过程如右图所示。下列说法错误的是
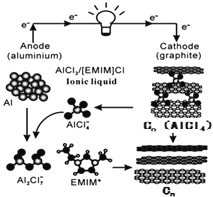
A.放电时负极的反应为:![]()
B.放电时石墨烯为正极,发生还原反应
C.充电时石墨烯与电源的正极相连
D.充电时的总反应为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植排斥,其结构简式如下图所示。
下列有关麦考酚酸说法正确的是( )
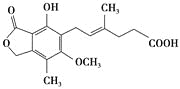
A.在一定条件下可与氢气发生加成反应,最多消耗氢气5 mol
B.不能与FeCl3溶液发生显色反应
C.在一定条件下可发生氧化、还原、取代、消去反应
D.1 mol麦考酚酸最多能与3 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列液体均处于25℃,有关叙述正确的是( )
A.某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐
B.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
C.将1L0.1mol·L-1的Ba(OH)2溶液稀释为2L,pH=12
D.pH=8的NaOH溶液稀释100倍,其pH=6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ)。制三氯化铬的流程如下:

(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤的原因是________,如何判断其已洗涤干净:_____
(2)已知CCl4沸点为76.8 ℃,为保证稳定的CCl4气流,适宜加热方式是______。
(3)用如图装置制备CrCl3时,主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400 ℃,开始向三颈烧瓶中通入氮气,使CCl4蒸气经氮气载入反应管进行反应,继续升温到650 ℃;③三颈烧瓶中装入150 mL CCl4,并加热CCl4,温度控制在50~60 ℃之间;④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;⑤停止加热CCl4,继续通入氮气;⑥检查装置气密性。正确的顺序为:⑥→③→________。
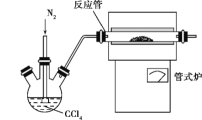
(4)已知反应管中发生的主要反应有:Cr2O3+3CCl4 ![]() 2CrCl3+3COCl2,因光气有剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式为_____。
2CrCl3+3COCl2,因光气有剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式为_____。
(5)样品中三氯化铬质量分数的测定
称取样品0.330 0 g,加水溶解并定容于250 mL容量瓶中。移取25.00 mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸腾后加入1 g Na2O2,充分加热煮沸,适当稀释,然后加入过量的2 mol/L H2SO4溶液至溶液呈强酸性,此时铬以Cr2O72-存在,再加入1.1 g KI,塞上塞子,摇匀,于暗处静置5分钟后,加入1 mL指示剂,用0.025 0 mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00 mL。已知Cr2O72-+6I-+14H+![]() 2Cr3++3I2+7H2O, 2Na2S2O3+I2
2Cr3++3I2+7H2O, 2Na2S2O3+I2![]() Na2S4O6+2NaI。
Na2S4O6+2NaI。
①该实验可选用的指示剂名称为______。
②移入碘量瓶的CrCl3溶液需加热煮沸,加入Na2O2后也要加热煮沸,其主要原因是____。
③样品中无水三氯化铬的质量分数为____(结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂辉石(主要成分为LiAl(SiO3)2,还含有Fe2O3、MgO、Al2O3等杂质)是最重要的提锂矿石原料,工业上以![]() -锂辉石为原料制备碳酸锂,其工艺流程如下:
-锂辉石为原料制备碳酸锂,其工艺流程如下:
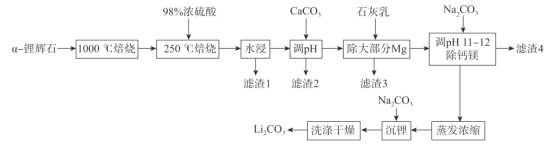
已知:①![]() -锂辉石化学惰性大,除HF外,几乎不与任何酸碱反应,
-锂辉石化学惰性大,除HF外,几乎不与任何酸碱反应, ![]() -锂辉石在高温下可转化为β一锂辉石,β一锂辉石具有更高的化学活性。
-锂辉石在高温下可转化为β一锂辉石,β一锂辉石具有更高的化学活性。
②β一锂辉石可与浓硫酸发生反应:2β一LiAl(SiO3)2+ H2SO4(浓)![]() Li2SO4 +Al2O3·4SiO2·H2O。
Li2SO4 +Al2O3·4SiO2·H2O。
③部分金属氢氧化物开始沉淀和完全沉淀的pH如表:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
请回答下列问题:
(1)将LiAl(SiO3)2改写成氧化物的形式为_______,1000 °C焙烧![]() -锂辉石的目的为_____.
-锂辉石的目的为_____.
(2)滤渣2的主要成分为________调节pH值的范围为________。
(3)“除大部分Mg”步骤的离子方程式为______________。
(4)实验室蒸发浓缩操作中所需的仪器为酒精灯、铁架台(带铁圈)、______________。
(5)洗涤过程中检验沉淀是否洗涤干净的操作为________________________________。
(6)碳酸锂是制备锂离子电池的原料之一,某锂离子电池以CoP3作为负极材料,以LiM1.5Ni0.5O4作为正极材料,以可传导Li+的无机固体电解质c-LATP作为电解液,其工作时电池反应为Li1-x Mn0.5Ni0.5O4 + Lix(CoP3 )![]() LiMn1.5Ni0.5O4+(CoP3),则该电池放电时负极的电极反应式为_________________,充电时阳极的电极反应式为_____________。
LiMn1.5Ni0.5O4+(CoP3),则该电池放电时负极的电极反应式为_________________,充电时阳极的电极反应式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2A为二元弱酸,常温下,向一定体积的0.1 mol·L-1的H2A溶液中逐滴加入一定浓度的NaOH溶液,溶液中不同形态的粒子(H2A、HA-、A2- )的物质的量分数a(X)随pH的变化曲线如图所示,![]()
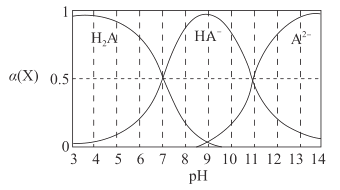
下列说法错误的是
A.K1(H2A)=1.0×10 -7B.K2(H2A)=1.0×10-11
C.pH=9时,c(Na+ )<c(HA- )+ 2c(H2A)D.pH=7时,c(Na+ )=c(H2A)+2c(A2- )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y是主族元素,I为电离能,单位是KJ/mol.根据下表所列数据判断错误的是( )
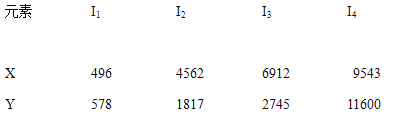
A. 元素X的常见化合价是+1价
B. 元素Y是ⅢA族的元素
C. 元素X与氯形成化合物时,化学式可能是XCl
D. 若元素Y处于第3周期,它可与冷水剧烈反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果酸的结构简式为HOOC![]() CH2—COOH,下列说法正确的是
CH2—COOH,下列说法正确的是
A. 苹果酸中能发生酯化反应的官能团有2种
B. 1mol苹果酸可与3mol NaOH发生中和反应
C. 1mol苹果酸与足量金属Na反应生成生成1mol H2
D. HOOC—CH2—CH(OH)—COOH与苹果酸互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com