
| A. | 同分异构现象只存在于有机物和无机物之间 | |
| B. | 同分异构现象不存在于无机物之间 | |
| C. | 在无机化合物和有机化合物间一定存在同分异构现象 | |
| D. | 在无机化合物和有机化合物间可能存在同分异构现象 |
分析 同分异构体主要存在有机物中,但是无机物中也存在同分异构体,如: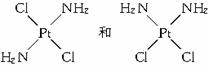 ,也可以存在于有机物和无机物之间,如:尿素[CO(NH2)2]和氰酸铵[NH4CNO],但有机物、无机物不一定存在同分异构现象;
,也可以存在于有机物和无机物之间,如:尿素[CO(NH2)2]和氰酸铵[NH4CNO],但有机物、无机物不一定存在同分异构现象;
解答 解:A.无机物中也存在同分异构体,如: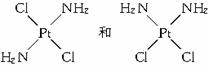 ;有机物与无机物之间也可出现同分异构体,如:尿素[CO(NH2)2]和氰酸铵[NH4CNO],故A错误;
;有机物与无机物之间也可出现同分异构体,如:尿素[CO(NH2)2]和氰酸铵[NH4CNO],故A错误;
B、无机物中也存在同分异构体,如: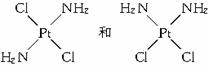 ,故B错误;
,故B错误;
C、在无机化合物和有机化合物间可能存在同分异构现象,如:尿素[CO(NH2)2]和氰酸铵[NH4CNO],故C错误;
D、在无机化合物和有机化合物间可能存在同分异构现象,如:尿素[CO(NH2)2]和氰酸铵[NH4CNO],故D正确;
故选D.
点评 本题考查了同分异构体、同分异构现象的判断,题目难度不大,注意掌握同分异构体主要存在有机物中,但是无机物中也存在同分异构体,也可以存在于有机物和无机物之间.


科目:高中化学 来源: 题型:选择题
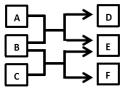 X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol•L-1D溶液的pH为13(25℃).它们满足如图转化关系,则下列说法正确的是( )
X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol•L-1D溶液的pH为13(25℃).它们满足如图转化关系,则下列说法正确的是( )| A. | 由X、Y、Z、W四种元素组成的盐溶液pH小于7 | |
| B. | 化合物F中含有共价键和离子键 | |
| C. | 0.1molB与足量C完全反应共转移电子数为0.2NA | |
| D. | Z元素的最高正价为+6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
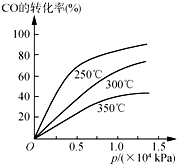 工业上一般在密闭容器中采用下列反应合成甲醇:
工业上一般在密闭容器中采用下列反应合成甲醇:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
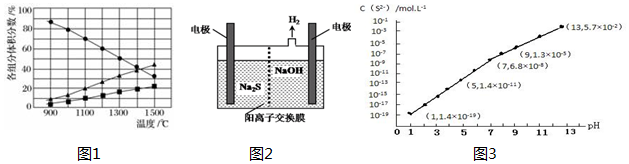
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
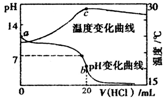
| A. | a点由水电离出的c(H+)<1.0×10-14mol•L-1 | |
| B. | b点时存在c(NH4+)+c(NH3•H2O)=c(C1-) | |
| C. | c点以后溶液温度下降的原因是盐酸的持续加入 | |
| D. | 在整个过程中可能会出现的离子浓度关系:c(NH4+)=c(C1-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 操作 | 2小时后Cu2+浸出率/% |
| I | 加入足量0.10mol•L-1 Fe2(SO4)3溶液 | 78.2 |
| II | 加入足量0.10mol•L-1 Fe2(SO4)3溶液,通入空气 | 90.8 |
| III | 加入足量0.10mol•L-1 Fe2(SO4)3溶液,再加入少量0.0005mol•L-1 Ag2SO4溶液 | 98.0 |
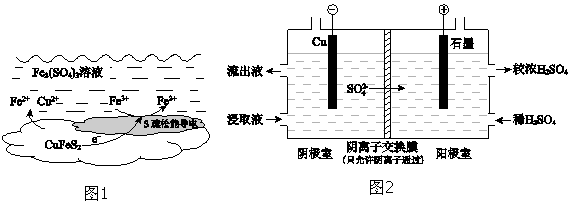
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | NaHA的电离方程式为NaHA?Na++HA- | B. | B点:c(H2A)+c(H+)=c(OH-)+c(A2-) | ||
| C. | C点:c(Na+)=c(A2-)+c(HA-) | D. | D点:c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前的质量/g | 4 | 10 | 1 | 25 |
| 反应后的质量/g | 未测定 | 21 | 10 | 9 |
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com